
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于温水(40℃~80℃)、乙醇、乙酸乙酯,难溶于氯仿(氯仿通常是无色液体,不溶于水,密度约为水的1.5倍)。某实验小组设计如图实验流程从茶叶中提取茶多酚:

请回答下列问题:
(1)①将茶叶粉碎的目的是____________。
②用水浸取茶多酚时,实验小组发现搅拌速度越快,茶多酚浸出率下降,可能原因是_______。
(2)下列有关实验基本操作正确的是________。
A.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
B.分液漏斗使用前须检验是否漏水并洗净备用
C.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
D.操作③分液时,溶液④应该从分液漏斗下口放出
(3)采用减压蒸发的理由是____________。
(4)溶液①在分液漏斗的_______(填“上”或“下”)层。
(5)为了进一步对粗产品进行提纯,可以采用的提纯方法是_____________。
(6)在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
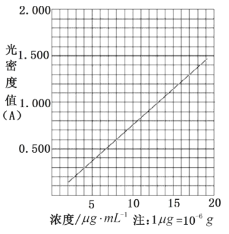
称取2.00g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00 mL,加过量Fe3+和K3Fe(CN)6酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值A=1.200,经过计算产品的纯度是_______(以质量分数表示,保留至小数点后一位)。
【答案】增大接触面积,提高浸出速率 茶多酚易被氧气氧化,搅拌越快,茶多酚氧化速率越快,浸出率越低 BD 降低蒸发温度,防止茶多酚氧化或分解 下 重结晶 80.0%
【解析】
分析题中实验步骤,从茶叶中提取茶多酚,经过操作①可得滤液和滤渣,可知操作①应为过滤。将滤液减压蒸发,得到浓缩液,向其中加入氯仿,经操作得到溶液①和溶液②,可知操作②为分液过程,根据题给信息,茶多酚难溶于氯仿,则氯仿用来溶解茶多酚的杂质。向溶液②中加入乙酸乙酯,并经操作③得到溶液③和溶液④,可知操作③同操作②,为分液过程。已知茶多酚易溶于乙酸乙酯,故用乙酸乙酯作为萃取剂进行萃取,分液后得到的溶液③经减压蒸馏得到粗产品。结合实验具体操作和茶多酚的性质进行分析。
(1)①增大接触面积,提高浸出速率
②茶多酚易被氧气氧化,搅拌越快,茶多酚氧化速率越快,浸出率越低
(2)
A.过滤时,为防止戳破滤纸,不可用玻璃棒搅拌,A项错误;
B.带活塞的仪器使用前均须检验是否漏液,分液漏斗使用前须检验是否漏水并洗净备用,B项正确;
C.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上静置后分液,C项错误;
D.溶液④是乙酸乙酯,水层在下层,从分液漏斗下口放出,D项正确;
答案选BD
(3)减压蒸馏适用于高沸点物质和那些在常压蒸馏时未达到沸点就已受热分解、氧化或聚合的化合物的分离和提纯,因为茶多酚还原性强,易被氧气氧化,用减压蒸馏可降低蒸发温度,防止茶多酚氧化或分解;答案为:降低蒸发温度,防止茶多酚氧化或分解;
(4)根据流程分析,茶多酚难溶于氯仿,所以,氯仿的主要作用是溶解杂质,因而茶多酚主要在溶液②中,并且氯仿的密度比水大,所以在下层,答案为:下;
(5)提纯粗产品,可用重结晶这一提纯方法进行提纯,答案:重结晶;
(6)由图可知,溶液光密度值A=1.200,则茶多酚的浓度为![]() ,此时溶液中茶多酚的质量为
,此时溶液中茶多酚的质量为![]() ,产品中茶多酚的质量为
,产品中茶多酚的质量为![]() ,故产品的纯度为
,故产品的纯度为![]() ;答案为:80.0%。
;答案为:80.0%。


科目:高中化学 来源: 题型:
【题目】把铝粉和四氧化三铁粉末配成铝热剂并分成两等份,前一份在高温下恰好完全反应,将生成物与足量的盐酸充分反应;后一份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是
A.1:1B.3:4C.9:8D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,他立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是
2MgO+C,下列关于该反应的判断正确的是
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于O原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol过氧化钠与4 mol碳酸氢钠固体混合,在密闭容器中,120°C充分反应后,排出气体,冷却,有固体残留。下列分析正确的是
A. 残留固体是4 mol Na2CO3
B. 残留固体是Na2CO3和NaOH的混合物
C. 反应中转移4 mol电子
D. 排出的气体是3 mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是

A.放电时,负极反应:2Mg-4e-+2Cl-=[Mg2Cl2]2+
B.充电时,Mg箔接电源的负极
C.放电时,Na+通过交换膜从左室移向右室
D.外电路中通过0.1mol电子的电量时,正极质量变化为2.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 铁与FeCl3溶液反应:Fe+Fe3+===2Fe2+
B. Fe与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
C. FeCl2溶液与Cl2反应:Fe2++Cl2===Fe3++2Cl-
D. Fe(OH)3与盐酸反应:Fe(OH)3+3H+===Fe3++3H2O
【答案】D
【解析】A、电荷不守恒,应为Fe+2Fe3+=3Fe2+,故A错误;B、违反反应事实,应为Fe+2H+=Fe2++H2↑,故B错误;C、电荷不守恒,应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;D、氢氧化铁是难溶物质,不能拆写成离子,发生中和反应,故D正确。
点睛:离子反应方程式正误判断中,一先看是否符合客观事实,二看电荷数是否相等,三看拆写是否正确,四看是否缺少反应。
【题型】单选题
【结束】
6
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3可用于照相业作定影剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制备,装置如图。
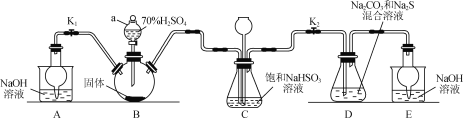
(1)仪器a的名称为____。
(2)A装置中,NaOH溶液的作用是___。
(3)D中生成Na2S2O3的化学方程式为___。
(4)装置C的作用有___、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是___。
(5)本实验所需的Na2S可由硫化钠碱坯(主要含Na2S,还含少量Na2SO4、炭粉等杂质)制备。
已知Na2S的溶解度、固相成分与温度的关系如表:
温度/℃ | 溶解度/g | 固相 |
-10 | 10.3 | Na2S·9H2O+冰 |
10 | 13.6 | Na2S·9H2O |
20 | 18.7 | Na2S·9H2O |
40 | 28.5 | Na2S·9H2O |
48 | 35.7 | Na2S·9H2O+Na2S·6H2O |
60 | 39.1 | Na2S·6H2O |
80 | 49.1 | Na2S·6H2O |
91.5 | 61.3 | Na2S·6H2O+Na2S·5.5H2O |
请补充完整由硫化钠碱坯制备Na2S·9H2O晶体的实验方案:边搅拌边将适量蒸馏水加入硫化钠碱坯中,过滤,__,得到Na2S·9H2O晶体(须用的试剂:BaS、无水乙醇)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧0.1 mol某有机物得0.2 mol CO2和0.3 mol H2O,由此得出的结论不正确的是( )
A. 该有机物分子的结构简式为CH3—CH3
B. 该有机物中碳、氢元素原子数目之比为1∶3
C. 该有机物分子中不可能含有![]() 双键
双键
D. 该有机物分子中可能含有氧原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com