
 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.分析 探究铜与浓硫酸反应气体产物的性质,由实验装置可知,乙中X为圆底烧瓶,在X中发生Cu与浓硫酸的反应生成二氧化硫,若甲探究二氧化硫的漂白性,Y为品红,且甲中导管长进短出,最后丙为尾气处理装置,吸收过量的二氧化硫,
(1)根据X的构造可知其名称为圆底烧瓶;
(2)Y由于检验二氧化硫,二氧化硫能够使品红溶液褪色,可用品红溶液;
(3)二氧化硫有毒,多余的二氧化硫需要用氢氧化钠溶液吸收,避免污染空气;氢氧化钠与二氧化硫反应生成硫酸钠和水;
(4)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水.
解答 解:(1)由图可知,仪器X的名称为圆底烧瓶,
故答案为:圆底烧瓶;
(2)若甲探究二氧化硫的漂白性,Y溶液可以是品红溶液,相应的实验现象是溶液红色褪去(若探究二氧化硫的还原性,Y为酸性KMnO4溶液,观察到紫色褪去等),
故答案为:品红溶液;溶液红色褪去;
(3)二氧化硫有毒,不能排放在环境中,则丙装置的作用是除去二氧化硫尾气,避免污染空气,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O,
故答案为:除去二氧化硫尾气,避免污染空气;2NaOH+SO2=Na2SO3+H2O;
(4)铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
点评 本题考查浓硫酸的性质实验,为高频考点,把握实验装置的作用、实验技能、元素化合物知识为解答的关键,侧重分析与实验能力的考查,注意甲装置可探究的性质,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L该溶液中含KNO3101g | |
| B. | 100 mL该溶液中含KNO3 0.01mol | |
| C. | 从1L该溶液中取出500 mL后,剩余溶液的浓度为0.05 mol/L | |
| D. | 1L水中溶解0.1 mol KNO3,即可配得0.1 mol/L KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?CO32-+H3O+ | B. | HCO3-+OH-?CO32-+H2O | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 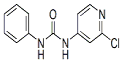 | 白色结晶粉末 | 170~172°C | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
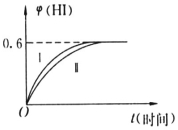 将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).
将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
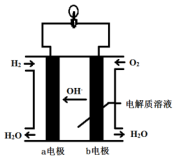 英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.
英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com