
【题目】在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应,n(NO)随时间的变化如下表:
时间/S | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为___________。
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是______热反应(填:“吸”、“放”)
(3)若改变某一条件,达新平衡时n(NO)= 0.06 mol,下列说法正确的是_______。
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.可能是缩小了容器的体积
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式_________。
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,平衡时NO的转化率a___b(填“大于”“小于”“等于”)
【答案】0.0015molL-1s-1 放热 C 2NO(g)+O2(g)![]() 2NO2(g) H= -12.5akJmol-1 <
2NO2(g) H= -12.5akJmol-1 <
【解析】
(1)从0~20s,NO气体物质的量由0.20mol减小到0.08mol,则参加反应的NO为0.12mol,参加反应的O2为0.06mol,由此可求出用O2表示的该反应的速率。
(2)若升温到850℃,平衡后n(NO)= n(NO2)=0.10mol,则表明平衡逆向移动。
(3)A.移去部分NO,平衡向逆反应进行;
B.向容器中加入了一定量的NO气体,虽然平衡正向移动,但平衡时NO的物质的量增大;
C.缩小了容器体积,相当于加压,平衡正向移动。
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,则0.16molNO完全反应,放出热量akJ,由此可求出2molNO参加反应,放出热量12.5akJ,便可写出在此条件下该反应的热化学方程式。
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,随着反应的进行,混合气的物质的量减小,b容器为恒压容器,则b中活塞不断左移,相当于a容器加压,平衡正向移动,由此可确定平衡时NO的转化率a与b的关系。
(1)从0~20s,NO气体物质的量由0.20mol减小到0.08mol,则参加反应的NO为0.12mol,参加反应的O2为0.06mol,v(O2)=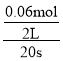 =0.0015molL-1s-1。答案为:0.0015molL-1s-1;
=0.0015molL-1s-1。答案为:0.0015molL-1s-1;
(2)若升温到850℃,平衡后n(NO)= n(NO2)=0.10mol,则表明平衡逆向移动,该反应是放热反应。答案为:放热;
(3)改变某一条件,是NO的物质的量从0.07mol减小到0.06mol,
A.移去部分NO,平衡向逆反应进行,A不正确;
B.向容器中加入了一定量的NO气体,虽然平衡正向移动,但平衡时NO的物质的量增大,B不正确;
C.缩小了容器体积,相当于加压,平衡正向移动,C正确;
故选C。答案为:C;
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,则0.16molNO完全反应,放出热量akJ,由此可求出2molNO参加反应,放出热量12.5akJ,此条件下该反应的热化学方程式为2NO(g)+O2(g)![]() 2NO2(g) H= -12.5akJmol-1。答案为:2NO(g)+O2(g)
2NO2(g) H= -12.5akJmol-1。答案为:2NO(g)+O2(g)![]() 2NO2(g) H= -12.5akJmol-1;
2NO2(g) H= -12.5akJmol-1;
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,随着反应的进行,混合气的物质的量减小,b容器为恒压容器,则b中活塞不断左移,相当于a容器加压,平衡正向移动,NO的转化率增大,由此可确定平衡时NO的转化率a<b。答案为:<。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.64 g SO2含有氧原子数为1NA
B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1NA
C.标准状况下,22.4 L H2O的分子数为1NA
D.常温常压下,14 g N2含有分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸和甲醇为原料制备苯甲酸甲酯。有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(gcm-3) | 水溶性 | |
苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。回答下列问题:
(1)该反应的化学方程式为_____。
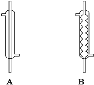
(2)实验中,应选择_____(填序号)作为冷凝回流装置,该仪器的名称为_____。
(3)使用过量甲醇的原因是_____。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。

(4)饱和碳酸钠溶液的作用是_____,操作b的名称为_____。
(5)该实验中制得苯甲酸甲酯8.5g,则苯甲酸甲酯的产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为1 mol/L的FeCl3、CuCl2的混合溶液100 mL,向该溶液中加入5.6 g铁粉充分反应(溶液的体积变化忽略不计)。已知,氧化性Fe3+> Cu2+下列有关叙述正确的是( )
A.反应后的溶液中n(Fe2+)是0.15 molB.反应后的溶液中不存在Fe3+和Cu2+
C.反应后残留固体为3.2 gD.反应后残留固体中可能含有未反应的铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液的成分是NaClO,某化学研究性学习小组在实验室制备NaClO并探究其性质。该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。(查阅资料:饱和NaClO溶液pH为11)。回答下列问题:
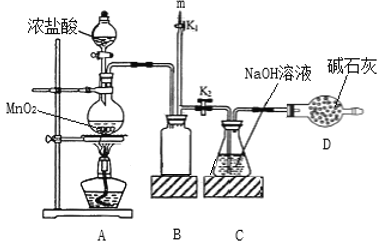
(1)装置A中发生反应的离子方程式为_______。
(2)实验结束后,在m处最好连接盛________(填“NaOH 溶液”或“水”) 的注射器,然后打开K1关闭K2,最后再拆除装置。
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1 Na2S2O3 标准溶液滴定,滴定终点时两次耗Na2S2O3 溶液体积的平均值为16.00mL。(已知:I2+2S2O32- =2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:______________________________。
②滴定终点的现象为__________________________________________________。
③C瓶溶液中NaClO含量为____________g·L-1。
④若盛Na2S2O3 标准溶液的滴定管未用Na2S2O3 标准溶液润洗,则测得C瓶溶液中NaClO含量__________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A.标准状况下,22.4 L H2O所含的分子数为NA
B.分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA
C.1L一氧化碳气体一定比1L氧气的质量小
D.常温常压下8gO3中含有8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 合成氨工业生产中所用的α—Fe催化剂的主要成分为FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,此时混合物中铁的质量分数为__________________(保留两位小数)。
(3)写出由C(炭粉)与Fe2O3在高温下反应制备α—Fe催化剂的化学方程式(另一种产物可溶于水):________________。
(4)为制得这种活性最高的催化剂,理论上应向480gFe2O3粉末加入炭粉的质量是______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3 ![]() 2Fe + Al2O3,下列关于该反应说法正确的是
2Fe + Al2O3,下列关于该反应说法正确的是
A. Al 是还原剂 B. Fe2O3 发生氧化反应
C. Fe 是氧化产物 D. 当生成 1 mol Fe 时,转移 6 mol 电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com