
25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析正确的是( )
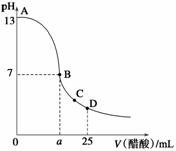
A.B点的横坐标a=12.5
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
科目:高中化学 来源: 题型:
中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ----------------------------------------------------------- -------------------------( )
-------------------------( )
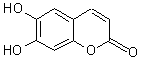 A 2 mol Br2 2 mol NaOH
A 2 mol Br2 2 mol NaOH
B 2 mol Br2 3 mol NaOH
C 3 mol Br2 4 mol NaOH
D 4 mol Br2 4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为:
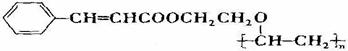
按图示可以合成甲,其中试剂乙可由相对分子质量为26的烃与水加成制得。
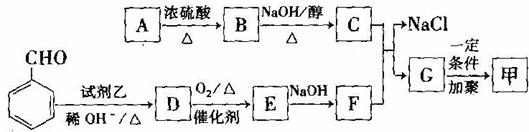
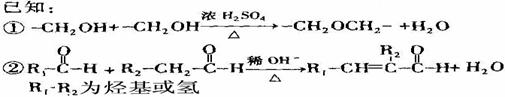
回答下列问题:(1)试剂乙的名称是. ;B→C的反应类型是 。
(2)质谱图显示A的相对分子质量是80.5,A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2∶
2∶l,则A的结构简式为 。
(3)写出下列反应的化学方程式。
①D→E的反应 ;
②C与F的反应 。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g) ΔH=
2H2O(g) ΔH=
-483.6 kJ·mol-1,则氢气的燃烧热 为241.8 kJ·mol-1
为241.8 kJ·mol-1
B.已知NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l)
NaCl(aq)+H2O(l)
ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
C.已知2C(s)+2O2(g) 2CO2(g) ΔH=a
2CO2(g) ΔH=a
2C(s)+O2(g) 2CO(g) ΔH=b,则a>b
2CO(g) ΔH=b,则a>b
D.已知P(白磷,s) P(红磷,s
P(红磷,s ) ΔH<0,则白磷比红磷稳定
) ΔH<0,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液的正确判断是( )
A.在pH=12的溶液中,K+、Cl-、HCO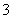 、Na+可以大量共存
、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO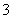 、SO
、SO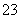 、K+可以大量共存
、K+可以大量共存
C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液中存在BOH===B++OH-
D.由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O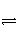
 HA+OH
HA+OH
-
查看答案和解析>>
科目:高中化学 来源: 题型:
.用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
| X | Y | Z | W | |
| A | C | Fe | NaCl | H2O |
| B | Pt | Cu | CuSO4 | CuSO4溶液 |
| C | C | C | H2SO4 | H2O |
| D | Ag | Fe | AgNO3 | AgNO3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO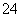 和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为________。
和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为________。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理______________________。
(3)液氨的电离类似于水,试写出液氨的电离方程式______________;在液氨中加入NH4Cl,平衡将向________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中不正确的是( )
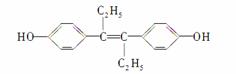
A.该药物可以用有机溶剂萃取
B.可发生加聚反应生成体型高分子化合物
C.1 mol该有机物可以与5 mol Br2发生反应
D.该有机物分子中可能有16个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用分液漏斗、锥形瓶、导管、注射器、双孔胶塞、秒表和铁架台 (选填“可以”、“不可以”)测定锌和稀硫酸反应生成氢气的反应速率
(2)为证明盐的水解是吸热反应,四位学生分别设计了如下实验方案,其中正确的是___
甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明盐类水解是吸热反应
丙.将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
(3)用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作造成测定结果偏高的是
A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失
C.滴定终点读数时,仰视滴定管刻度,其他操作正确
(4)用物质的量浓度为0.1000 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,分别取20.00 mL 草酸溶液于3个洁净的锥形瓶中,用标准的KMnO4(H+)溶液滴定至终点,数据如下:
| 测定次数 | 第一次 | 第二次 | 第三次 |
| 初始读数(mL) | 0.40 | 0.90 | 0.00 |
| 终点读数(mL) | 25.05 | 21.00 | 19.90 |
已知:相关反应方程式为:5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
① 标准KMnO4溶液应装在 (选填“酸式”或“碱式”)滴定管中;
② 判断已达滴定终点的现象是:____________________________________ ;
③ 实验测得草酸溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com