
【题目】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
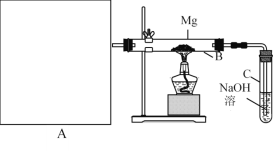
Ⅰ.用上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。用80%的H2SO4溶液与Na2SO3固体制取SO2 。
(1) 写出装置B中发生的主要反应的化学方程式_____________________。装置C中NaOH溶液的作用是___。
(2)你认为该装置不足之处是什么?__________________________只要答出两点即可)。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(3) 该小组“实验室制Si”的化学方程式是______________________________________。
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____________。
【答案】3Mg+SO2 = 2MgO+MgS 吸收多余的SO2,防止污染环境 在A和B之间没有连接一干燥装置;C装置未与大气相通;在镁下方未垫一不锈钢片,镁与玻璃管反应;未设计一防倒吸装置 2Mg+SiO2![]() 2MgO+Si 金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃或用化学方程式表示:2Mg+Si
2MgO+Si 金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃或用化学方程式表示:2Mg+Si![]() Mg2Si Mg2Si+2H2SO4=MgSO4+SiH4↑SiH4+2O2=SiO2+2H2O
Mg2Si Mg2Si+2H2SO4=MgSO4+SiH4↑SiH4+2O2=SiO2+2H2O
【解析】
我们熟悉Mg与CO2反应,现在要写出Mg与SO2反应,显然需使用类推法。
所以2Mg+SO2=2MgO+S,同时还应考虑物质性质的差异性,即生成的S还能继续与Mg反应生成MgS。
在分析装置的不足时,需要考虑气体与热的固体反应需干燥,气体排出时需保持内外压强的平衡,易溶于水气体用液体吸收时需防倒吸,以及活泼金属镁与硬质玻璃管成分SiO2的反应等。
同样,Mg与SiO2的反应也采用类推法,起初生成Si和MgO,后来Si与Mg继续反应生成Mg2Si,至于此反应的产物,题中实验现象也给了我们暗示。
Ⅰ.(1)装置B中发生的是Mg与SO2的反应,首先发生置换反应,生成MgO和S,S再与Mg反应生成MgS,主要反应的化学方程式3Mg+SO2 =2MgO+MgS。
答案为:3Mg+SO2 =2MgO+MgS;
SO2是污染环境的气体,需进行尾气处理。装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境。
答案为:吸收多余的SO2,防止污染环境。
(2)该装置不足之处是:在A和B之间没有连接一干燥装置;C装置未与大气相通;在镁下方未垫一不锈钢片,镁与玻璃管反应;未设计一防倒吸装置。
答案为:在A和B之间没有连接一干燥装置;C装置未与大气相通;在镁下方未垫一不锈钢片,镁与玻璃管反应;未设计一防倒吸装置。
Ⅱ.(3) 该小组“实验室制Si”的化学方程式是2Mg+SiO2![]() 2MgO+Si。
2MgO+Si。
答案为:2Mg+SiO2![]() 2MgO+Si。
2MgO+Si。
(4)“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃。或用化学方程式表示:2Mg+Si![]() Mg2Si,Mg2Si+2H2SO4=MgSO4+SiH4↑,SiH4+2O2=SiO2+2H2O。
Mg2Si,Mg2Si+2H2SO4=MgSO4+SiH4↑,SiH4+2O2=SiO2+2H2O。
答案为:金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃。或用化学方程式表示:2Mg+Si![]() Mg2Si,Mg2Si+2H2SO4=MgSO4+SiH4↑,
Mg2Si,Mg2Si+2H2SO4=MgSO4+SiH4↑,
SiH4+2O2=SiO2+2H2O。


科目:高中化学 来源: 题型:
【题目】某同学在实验室进行了如图所示的实验,下列说法中错误的是

A. X、Z烧杯中分散质相同
B. Y中反应离子方程式为3CaCO3+2Fe3++3H2O==2Fe(OH)3(胶体)+3CO2↑+3Ca2
C. 利用过滤的方法,可将Z中固体与液体分离
D. Z中分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。请回答下列问题(橡皮管、导管可自由选用)。
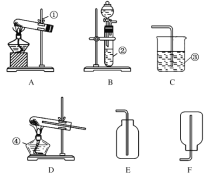

(1)实验室制取并收集氧气时应选择__________和__________相连接,制取并收集氢气时应选择__________和__________相连接。
(2)进行木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________。
(3)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。已知甲烷的密度比空气小,不溶于水。则制取甲烷气体可选用的装置为________,收集甲烷气体时可选用的装置为________。
(4)如图是某学生设计的一种有洗气、贮气等用途的装置。欲除去O2中混有的水蒸气,瓶中可盛________。当用排水法收集氢气时,瓶内先装满水,气体从________(填“a”或“b”,下同)导管口通入。若要用水将瓶中氢气排出,水应从________导管口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温定容的密闭容器中合成![]() 。下列不能说明反应2SO2(g)+O2(g)
。下列不能说明反应2SO2(g)+O2(g)![]() 2SO3(g)达到化学平衡状态的是 ( )
2SO3(g)达到化学平衡状态的是 ( )
A. ![]()
B. 容器内的压强不再改变
C. SO3的生成速率与SO2 的生成速率相等
D. SO2 的转化率不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.海带灰浸泡滤液中加入稀硫酸后再加入双氧水:2I-+ H2O2+4H+ = I2+2H2O
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.1L4mol·L-1 NaOH溶液中通入67.2LCO2(标准状况下),反应的离子方程式为:4OH- +3CO2 = 2HCO3-+CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
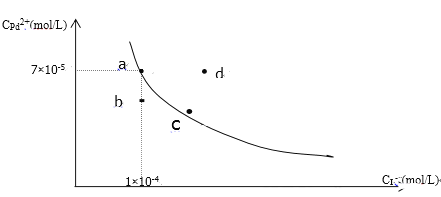
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
A.1.6gNH2-离子所含质子数为NA
B.常温常压下,200g8.5%的H2O2溶液中含氧原子数为NA
C.7.8gNa2O2晶体中所含离子总数为0.4NA
D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种耐高温、抗冲击、导电性好的优良工业材料。现通过反应:Al2O3+3C+N2![]() 2AlN+3CO来制取,下列有关该反应的说法中正确的是
2AlN+3CO来制取,下列有关该反应的说法中正确的是
A.Al2O3中Al元素化合价没有发生变化B.N2是氧化剂
C.CO作还原剂D.反应物C发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4.8gO3和0.2molCH4,在同温同压下的体积之比是__;相同质量的O2和SO2,所含分子的数目之比为__,所含O原子的物质的量之比为__,密度之比为__。
(2)标准状况下11.2 L N2所含分子数是___个。
(3)若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是__g。
(4)483g Na2SO4·10H2O中所含的Na+的物质的量是__,SO42-的物质的量是__,所含H2O分子的数目是___个。
(5)现有100 ml 1.00 mol/L NaCl溶液,其中所含Na+的质量是___g。
(6)下列物质能导电是__,属于电解质是__,属于非电解质的是__。(填序号,多选或错选扣分)①水银 ②烧碱 ③硫酸钡 ④氯化钠晶体 ⑤盐酸 ⑥蔗糖
(7)实验室配制480mL0.08mol/LNa2CO3溶液,需要十水碳酸钠晶体质量_______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com