
| A. | Y2为0.1 mol•L-1 | B. | X2为0.1 mol•L-1 | ||
| C. | Y2为0.35 mol•L-1 | D. | Z为0.3 mol•L-1 |
分析 在一定条件下,该反应可能向正反应方向进行也可能向逆反应方向进行,采用极限方法判断平衡时各物质浓度,如果平衡向正反应方向进行,反应物X2完全转化为Z,则Z最大、X2和Y2的浓度最小,如果平衡向逆反应方向进行,Z完全转化为生成物X2和Y2,则X2和Y2最大、Z最小,实际上该反应存在平衡状态,所以平衡时各物质浓度介于最大和最小之间,据此分析解答.
解答 解:如果平衡向正反应方向进行,反应物X2完全转化为Z,则Z最大、X2和Y2的浓度最小,根据方程式知,生成Z为0.2mol•L-1,消耗Y20.1mol•L-1,则X2最小为0、Y2最小为0.1mol•L-1、Z为0.3mol•L-1;如果平衡向逆反应方向进行,Z完全转化为X2和Y2,则X2和Y2最大、Z最小,X2为0.15mol•L-1、Y2为0.25mol•L-1,Z为0;
实际上该反应存在平衡状态,所以平衡时各物质浓度介于最大和最小之间,X2浓度在0-0.15mol•L-1之间、Y2浓度在0.1mol•L-1-0.25mol•L-1之间、Z浓度在0-0.3mol•L-1之间
A.平衡时Y2浓度在0.1mol•L-1-0.25mol•L-1之间,故A错误;
B.平衡时X2浓度在0-0.15mol•L-1之间,故B正确;
C.平衡时Y2浓度在0.1mol•L-1-0.25mol•L-1之间,故C错误;
D.平衡时Z浓度在0-0.3mol•L-1之间,故D错误;
故选B.
点评 本题考查化学平衡建立过程,侧重考查学生分析判断及计算能力,采用极限法分析解答即可,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
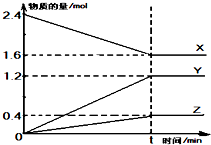 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-2-戊烯 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-2-戊烯 | D. | 2,2-二甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层有两个电子的元素并不都在第ⅡA族 | |
| B. | 第ⅠA族元素都是典型的金属元素 | |
| C. | 第ⅦA族的元素最外层都有七个电子 | |
| D. | 第三周期的元素的原子核外都有三个电子层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com