
A、
| ||||
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
| D、核外电子排布相同的微粒化学性质也相同 |


科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒不断搅拌. |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施:用玻璃棒引流. |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作:改用胶头滴管加水至刻度线. |
查看答案和解析>>
科目:高中化学 来源: 题型:
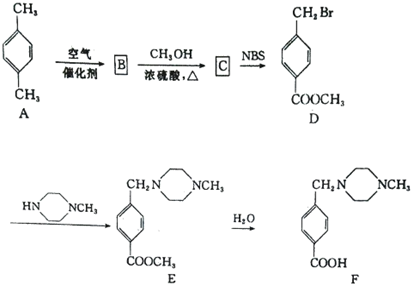
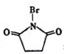 ,则反应C→D的化学方程式为
,则反应C→D的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
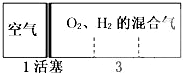
| A、①② | B、②④ | C、③④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HIO与HCN均为含有极性键的直线形极性分子 |
| B、SiO2与C02均为每摩含有4×6.02×1023对共用电子对的酸性氧化物 |
| C、Na2S浓溶液与稀盐酸分别滴加到饱和AgCl溶液中均一定有沉淀产生 |
| D、明矾与离子交换树脂均能将海水进行淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率关系是:2v正(A)=3v正(D) |
| B、若单位时间内生成x mol C的同时,消耗x mol A,则反应一定处于平衡状态 |
| C、达到化学平衡后,增大容器的容积,则正反应速率减小,逆反应速率增大 |
| D、达到化学平衡后,升高温度,则C的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、离子半径的大小顺序为W>Q>Y>Z |
| B、X、Y、W三种元素的电负性大小顺序为X>Y>W |
| C、X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 |
| D、元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com