
【题目】根据下列图示所得出的结论正确的是( )
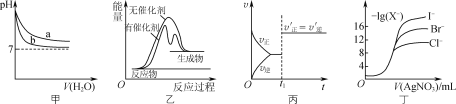
A. 图甲表示pH相同的NaOH溶液与氨水稀释过程pH的变化,曲线a对应氨水
B. 图乙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C. 图丙表示CO(g)+Cl2(g)![]() COCl2(g)的反应速率随时间的变化,在t1时改变的条件是加入催化剂
COCl2(g)的反应速率随时间的变化,在t1时改变的条件是加入催化剂
D. 图丁表示用0.0100mol·L-1的硝酸银标准溶液滴定浓度均为0.1000mol·L-1 Cl-、Br-及I-的混合溶液时,先沉淀的是Cl-
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是( )
A. 灼烧海带:
B. 将海带灰溶解后分离出不溶性杂质: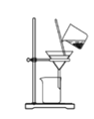
C. 制备Cl2,并将I-氧化为I2:
D. 以淀粉为指示剂,用Na2S2O3标准溶液滴定: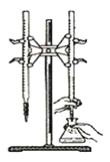
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为______mol/L。
⑵下列微粒:①S ②SO32- ③ Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是______![]() 填序号
填序号![]() ,只能表现出氧化性的是______
,只能表现出氧化性的是______![]() 填序号
填序号![]() 。
。
⑶一定条件下, PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为______mol;
⑷在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为______。
⑸自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2发生的反应可表示如下,请完成方程式的配平。____Al + ____NO3-+ ________ == ____AlO2- + ____N2↑ +____ H2O,
⑹某化学反应的反应物和产物:![]()
①该反应的氧化产物是______。
②若该反应方程式中I2和KIO3的计量数分别是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4 + KI + H2SO4→______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )

A. 盐酸中逐滴加入氢氧化钠溶液
B. 硫酸铜溶液中逐滴加入氢氧化钡溶液
C. 硫酸中逐滴加入氯化钡溶液
D. 盐酸中逐滴加入硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Al、Fe 三种金属的混合物与足量的稀硫酸反应,生成 2.8L H2(标准状况)则三种金属的物 质的量之和不可能是( )
A.0.12 molB.0.15 molC.0.09 molD.0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g)![]() CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应温度T/K | 500 | 500 | 600 |
反应物投入量 | 1 mol CO、 2 mol H2 | 2 mol CH3OH | 1 mol CO、 2 mol H2 |
平衡v正(H2)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡c(CH3OH)/(mol·L-1) | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(CO) | α2(CH3OH) | α3(CO) |
平衡常数K | K1 | K2 | K3 |
下列叙述正确的是( )
A. v1<v2,2c1>c2B. α1(CO)>α3(CO),v1<v3
C. p2>2p3,K1<K3D. c2>2c3,α2(CH3OH)+α3(CO)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答:

(1)画出G离子结构示意图________;
(2)写出B、I的化学式B________,I________;
(3)写出H的一种用途__________________________________;
(4)写出A受热分解的化学方程式_________________________;
(5)若H与C反应固体增重4.2 g,则参加反应的C气体在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。
②5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)沉淀反应的离子方程式是______________。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积31.60 mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为______。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如下图,其变化趋势的原因可能为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。

(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起_______的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂 除去。
(5)写出烧瓶a中发生反应的化学方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com