
| a(V2-V1) |
| V |
| a(V2-V1) |
| V |

| c(��)��V(��) |
| V(����) |
| a(V2-V1) |
| V |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��ʵ������ij��������Ʊ������ʼ��鼰�ռ�װ��ͼ��
��ͼ��ʵ������ij��������Ʊ������ʼ��鼰�ռ�װ��ͼ��
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
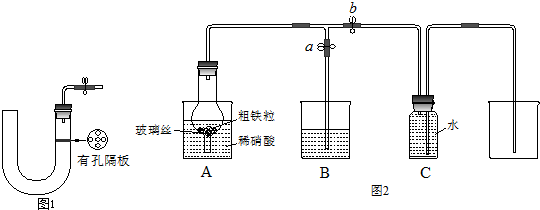
| ���� |
| ʵ�鲽�� | ���� | ��������� |
| ��һ�� | ȡ����Һ��װ���Թܣ����� ���е��뼸��KSCN��Һ�� |
|
| �ڶ��� | ����Һ��ɫ��ȥ����˵������Fe2+�� �������Ա仯����˵������Fe2+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ����� | ��Ʒ������/g | NaOH��Һ�����/mL | ���������/L |
�� | 7.4 | 40.00 | 1.68 |
�� | 14.8 | 40.00 | 3.36 |
�� | 22.2 | 40.00 | 1.12 |
�� | 37.0 | 40.00 | 0.00 |
��1��д��ʵ��������йص����ӷ���ʽ��
��2���ɱ�������ֱ���Ʋ��״����3.7 g��Ʒ����ͬ��ʵ��ʱ�����ɰ��������Ϊ��������
��3���Լ���û������(NH4)2SO4��NH4HSO4�����ʵ���֮�ȡ�
��4���������NaOH��Һ�����ʵ���Ũ����Ӧѡ���_________�����ݣ��ɴ����NaOH��Һ�����ʵ���Ũ��Ϊ���٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ϊ�˷��λ�����Ⱦ����β�������ۺ����ã�ij���᳧�ð�ˮ����β���е�SO2����������Һ�м���Ũ���ᣬ����ȡ��Ũ�ȵ�SO2��(NH4)2SO4��NH4HSO4���塣Ϊ�ⶨ����(NH4)2SO4��NH4HSO4�����������ɣ��ֳ�ȡ��Ʒ�ķݣ��ֱ������ͬŨ�ȵ�NaOH��Һ��40.00 mL��������120 �����ң�ʹ����ȫ���ݳ���(NH4)2SO4��NH4HSO4�ֽ��¶Ⱦ�����200 �桳������й�ʵ���������£���״������
| ʵ����� | ��Ʒ������/g | NaOH��Һ�����/mL | ���������/L |
| �� | 7.4 | 40.00 | 1.68 |
| �� | 14.8 | 40.00 | 3.36 |
| �� | 22.2 | 40.00 | 1.12 |
| �� | 37.0 | 40.00 | 0.00 |
��1��д��ʵ��������йص����ӷ���ʽ��
��2���ɱ�������ֱ���Ʋ��״����3.7 g��Ʒ����ͬ��ʵ��ʱ�����ɰ��������Ϊ��������
��3���Լ���û������(NH4)2SO4��NH4HSO4�����ʵ���֮�ȡ�
��4���������NaOH��Һ�����ʵ���Ũ����Ӧѡ���_________�����ݣ��ɴ����NaOH��Һ�����ʵ���Ũ��Ϊ���٣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com