
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于0.5amol | ||||||
C、改变温度,反应中转移电子的物质的量ne的范围:
| ||||||
D、改变温度,产物中KC1O3的最大理论产量为
|
| c(Cl-) |
| c(ClO-) |
| c(Cl-) |
| c(ClO-) |
| c(ClO-) |
| c(ClO3-) |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |
| 5 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 5 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
| A、由Fe和Cl2作用生成FeCl3可推知:Fe和I2作用生成FeI3 |
| B、由NaOH溶液可吸收CO2可推知:SiO2可溶于NaOH溶液 |
| C、由Fe3O4中铁元素呈+2、+3价可推知:Pb3O4中铅元素呈+2、+3价 |
| D、由Na在空气中燃烧生成Na2O2可推知:Li在空气中燃烧生成Li2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10Q | B、10Q~5Q |
| C、大于10Q | D、5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
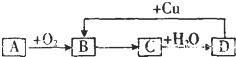 如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是( )①C ②N ③Si ④S ⑤Cl.
如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是( )①C ②N ③Si ④S ⑤Cl.| A、①② | B、②⑤ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com