
| A.把盛有溶液的分液漏斗敖在铁架台的铁圈中: |
| B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞: |
| C.检验分液漏斗活塞和上口玻璃塞是否漏液; |
| D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞: |
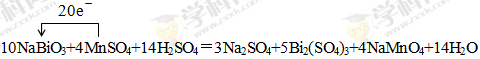 (3分,配平2分,电子转移的方向和数目1分,短线未改成等号的扣1分) ②Bi2(SO4)3(2分)
(3分,配平2分,电子转移的方向和数目1分,短线未改成等号的扣1分) ②Bi2(SO4)3(2分)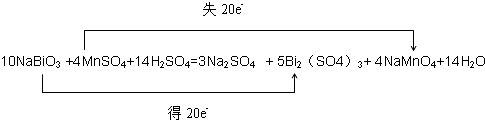
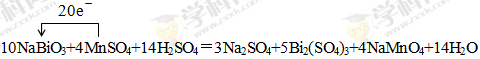 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应 |
| B.试管中发生的所有氧化还原反应共转移电子0.15 mol |
| C.反应后试管中剩余的固体混合物的总质量为7.2 g |
| D.反应生成铜和氧化亚铜的总物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 → Mn2++NO3-+H2O。下列叙述中正确的是( )
→ Mn2++NO3-+H2O。下列叙述中正确的是( )| A.该反应中NO2-是还原剂 |
| B.反应过程中溶液的pH 减小 |
| C.生成1 mol NaNO3时消耗2.5 mol KMnO4 |
D. 中的粒子是OH- 中的粒子是OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应的氧化剂是H2C2O4 | B.1molMnO4-在反应中失去5mol电子 |
| C.该反应右框内的产物是OH- | D.配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 | D.反应中硫酸作氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、 NaHSO4 |

| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | | SO2与Fe3+反应生成了Fe2+ |
| 方案③ | 往第二份试液中加入 | | SO2与Fe3+反应生成了SO42— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


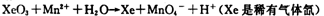


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com