
| A. | 氨基酸、多肽、蛋白质都具有两性 | |
| B. | 利用油脂在酸性条件下水解,可以产生甘油和肥皂 | |
| C. | 淀粉与纤维素分子式都为(C6H10O5)n,但结构不同,所以它们互为同分异构体 | |
| D. | 饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析 |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
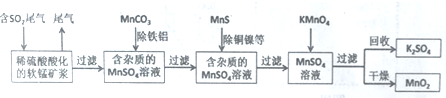
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 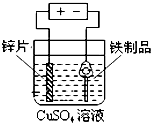 铁制品表面镀锌 | B. | 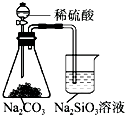 验证碳酸酸性强于硅酸 | ||
| C. | 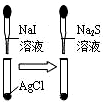 说明溶解性AgCl<AgI<Ag2S | D. |  浸在冷水中的玻璃球颜色较深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向苯酚的浓溶液中加入溴水,无沉淀产生 | 苯酚与溴水不反应 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去 | 使溶液褪色的气体只是乙烯 |
| D | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com