
| 425 |
| C(HC 2O 4 -)C(H +) |
| C(H 2C 2O 4) |
| x×x |
| 0.2-x |


科目:高中化学 来源: 题型:
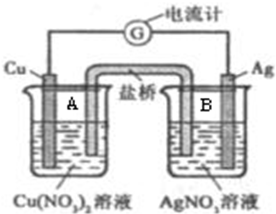 某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:
某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 分子筛具有均匀的微孔结构,分子筛筛分作用见图.
分子筛具有均匀的微孔结构,分子筛筛分作用见图.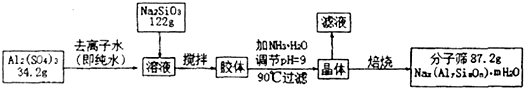
| ? |
| A |
| ? |
| A |
| ? |
| A |
| ? |
| A |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
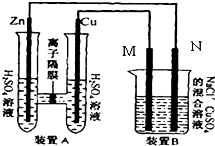 如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加
如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C5H12的烃有三种可能的结构 |
| B、乙醇分子中含有羟基,可以和金属Na反应生成H2 |
| C、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中相似的碳碳双键 |
| D、淀粉、蛋白质、油脂、葡萄糖在一定条件下均能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com