
分析 (1)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,计算反应生成二氧化碳的物质的量,结合方程式计算混合物中碳酸氢钠的物质的量,加热后剩余的固体物质加入硫酸至没有气体放出为止,发生反应:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,根据碳原子守恒计算混合物中碳酸钠的物质的量,再根据m=nM计算碳酸氢钠、碳酸钠的质量;
(2)根据Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,计算硫酸的物质的量,根据稀释定律计算稀释氢离子浓度,再根据pH=-lgc(H+)计算.
解答 解:(1)加热分解生成二氧化碳为$\frac{1.12L}{22.4L/mol}$=0.05mol,
由2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,可知原混合物中NaHCO3的物质的量为0.05mol×2=0.1mol,则原固体混合物中NaHCO3的质量为0.1mol×84g/mol=8.4g,
向剩下的固体中逐滴滴入稀硫酸至没有气体放出为止,并收集到CO22.24L,根据碳原子守恒可知:n(Na2CO3)=0.05mol+$\frac{2.24L}{22.4L/mol}$-0.1mol=0.05mol,故原混合物中Na2CO3的质量为0.05mol×106g/mol=5.3g,
答:原固体混合物中NaHCO3的质量为8.4g,Na2CO3的质量为5.3g.
(2)根据Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,可知硫酸的物质的量为0.1mol,则原硫酸溶液中氢离子浓度为$\frac{0.1mol×2}{0.05L}$=4mol/L,则稀释后溶液中氢离子浓度为$\frac{0.01L×4mol/L}{0.4L}$=0.1mol/L,故稀释后的pH=-lg0.1=1,
答:稀释后溶液pH为1.
点评 本题考查混合物有关计算、溶液pH计算,清楚发生的化学反应是解答本题的关键,注意利用守恒法计算碳酸钠的物质的量,难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和铝 | B. | 锌和铝 | C. | 镁和铝 | D. | 铜和铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用蘸过蒸馏水的玻璃棒蘸取硫酸钠溶液测其pH,不产生误差 | |
| B. | 称量氢氧化钠固体时,可以直接放在纸上称量 | |
| C. | 沾到试管上的银镜可用稀HNO3洗涤 | |
| D. | 如图可用于吸收HCl气体并防倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况时11.2LO2的质量为32g | B. | 16O的相对原子质量为32 | ||
| C. | 44gCO2和28gCO含有相同的分子数 | D. | 标准状况时44gCO2的体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠比碳酸氢钠的热稳定性要好 | |
| B. | 钠在空气中燃烧生成Na2O | |
| C. | 钠在发生化学反应时只作还原剂 | |
| D. | 钠单质暴露在空气中最终将变成Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
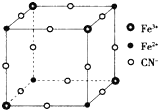 有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )
有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )| A. | 该晶体的化学式为MFe2(CN)6 | |
| B. | 该晶体熔融可导电,且属于化学变化 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③⑤ | D. | ④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com