
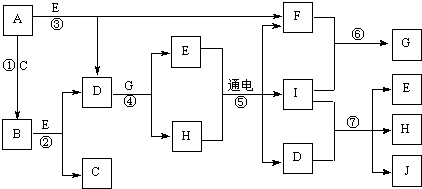
中学化学中常见的几种物质存在下图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)

回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)固体E中含有化学键的类型是 ,C与E反应的离子方程式为 。
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为 。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。

实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学的认为使a变红的是 (写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成
IO3-,从而使蓝色消失;二是 。
(1)
MnO2+4HCl(浓)  MnCl2+Cl2↑+ 2H2O(2分)
MnCl2+Cl2↑+ 2H2O(2分)
(2) 离子键、极性键(2分,答对一种给1分) Cl2 +2OH-=Cl-+ ClO-+ H2O(1分)
(3) ClO-+ Cl-+ 2H+ =Cl2 ↑+H2O(2分)
(4) ① SO2(或H2SO3) (1分) ② Cl2+2I-= 2Cl-+ I2(1分)
③ I2有氧化性,SO2能将I2还原成I-,从而使蓝色消失(1分)
【解析】
试题分析:C是一种黄绿色气体,则C是氯气。实验室中常用E溶液吸收多余的C,则E是氢氧化钠。A是一种黑色粉末状固体,能和B反应生成氯气,所以A是二氧化锰,B是浓盐酸。氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水。F电解熔融的氯化钠生成钠和氯气,因此F是氯化钠,H是次氯酸钠,次氯酸钠和盐酸发生氧化还原反应生成氯气。
(1)二氧化锰与浓盐酸反应的化学方程式为 MnO2+4HCl(浓)  MnCl2+Cl2↑+ 2H2O。
MnCl2+Cl2↑+ 2H2O。
(2)氢氧化钠是离子化合物,含有离子键和极性键。氯气是大气污染物,需要用氢氧化钠溶液吸收,因此氯气与氢氧化钠溶液反应的离子方程式为Cl2 +2OH-=Cl-+ ClO-+ H2O。
(3)次氯酸钠具有强氧化性,能氧化氯离子生成氯气,反应的离子方程式为ClO-+ Cl-+ 2H+ =Cl2 ↑+H2O。
(4)①因为SO2溶于水生成亚硫酸,溶液显酸性,也能使湿润的蓝色石蕊试纸显红色。
②片刻后,溶液上方出现黄绿色气体,该气体是氯气。氯气具有强氧化性,能氧化碘化钾生成单质碘,碘遇淀粉显蓝色,反应的离子方程式为Cl2+2I-=2Cl-+ I2。
③最终试纸b褪色,这说明单质碘被反应。单质碘既具有氧化性,也具有还原性。而SO2具有还原性,能把SO2氧化生成硫酸,因此SO2把I2还原成I-,从而使蓝色消失。
考点:考查无机框图题的判断;化学实验方案设计与评价等


科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 A-K是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,G、H为气态单质,I在常温下为液体,D、E、F的水溶液均呈碱性,由C的饱和溶液制取F或E是重要的化工生产.回答下列问题:
A-K是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,G、H为气态单质,I在常温下为液体,D、E、F的水溶液均呈碱性,由C的饱和溶液制取F或E是重要的化工生产.回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com