
| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | Z和Q形成的化合物为离子化合物 | |
| C. | 不存在由元素Z与元素W形成的化合物的水溶液 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
分析 Y原子的最外层电子数是其内层电子数的3倍,所以Y是氧元素,则X是氮元素,Z是第三周期中简单离子半径最小的元素,所以Z是铝元素,W与Y位于同一主族,所以W是硫元素,而X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,则Q是氯元素,由此分析解答.
解答 解:A、电子层数越多半径越大,电子层数相同核电荷数越多半径越小,所以rZ>rW>rQ>rX>rY,故A错误;
B、氯化铝是共价化合物,故B错误;
C、硫化铝只能在干态中存在,在溶液中转化为氢氧化铝和硫化氢,故C正确;
D、非金属性越强最高价氧化物对应水化物的酸性越强,非金属性Cl>S,所以元素W的最高价氧化物对应的水化物的酸性比Q的弱,故D错误;
故选C.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,C选项中注意硫化铝的工业制法.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7gH2O2中含有的电子总数为0.9NA | |
| B. | 92g NO2和N2O4的混合气中含有的氮原子数为2NA | |
| C. | 标准状况下,28 g CO与22.4 L O2所含原子数相等 | |
| D. | 1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
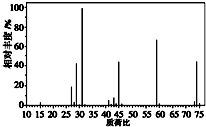 根据以下有关信息确定有机物的组成
根据以下有关信息确定有机物的组成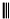 +
+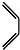 $\stackrel{△}{→}$
$\stackrel{△}{→}$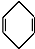 如果要合成
如果要合成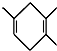 ,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
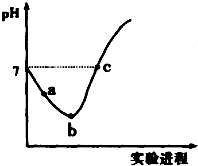 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| D. | c 点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
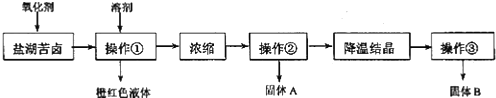
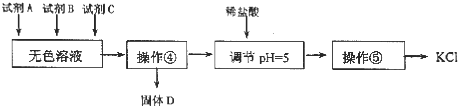
| A. | 要从橙红色液体中分离出单质溴,可采取的操作是蒸馏 | |
| B. | 操作②为过滤,主要目的是为了除去 MgSO4 | |
| C. | 试剂 C为K2CO3,固体D主要为Mg(OH)2、BaSO4,还有少量的BaCO3 | |
| D. | 若在操作④结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
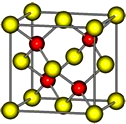 有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
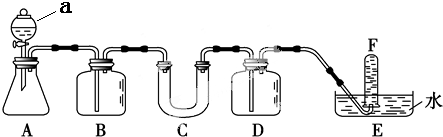
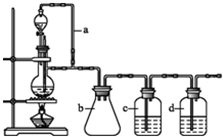
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和碳酸氢钠溶液 | |
| D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com