
【题目】如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )

A. 途径②增大O2浓度可提高SO2转化率
B. 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C. 途径②中SO2和SO3均属于酸性氧化物
D. 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2(g)为放热反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源(左池),以Al作阳极、Pb作阴极,电解稀硫酸(右池),使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O ![]() Al2O3+3H2↑。
Al2O3+3H2↑。
关闭K,电解过程中,以下判断正确的是
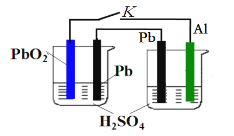
A. 两池中H+均移向Pb电极
B. 左池每消耗3 mol Pb,右池生成2 mol Al2O3
C. 左池Pb电极质量增加,右池Pb电极质量不变
D. 左池正极反应:PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废塑料的回收再生利用将工业垃圾变成极有价值的工业生产原料。具有不可忽略的潜在意义。利用如图所示的装置隔绝空气加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,以此探究废塑料的再利用。下列叙述正确的是
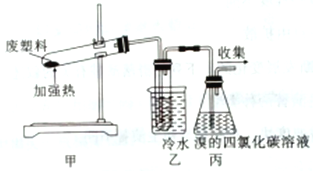
A. 聚丙烯的链节是-CH2-CH2-CH2-
B. 装置乙的试管中收集到的物质不能使酸性高锰酸钾溶液褪色
C. 装置丙中的试剂可吸收烯烃且出现溶液分层现象
D. 最后收集的气体可作燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫酸氢钠溶液中,c(Na+)>c(SO42-)B.醋酸钠溶液中,c(Na+)>c(CH3COO-)
C.碳酸钠溶液中,c(HCO3-)>c(OH--)D.碳酸氢钠溶液中,c(CO32-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)→C(g) ΔH,分两步进行:
①A(g)+B(g) →X(g) ΔH1;
②X(g) →C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B→X的活化能,下列说法正确的是( )

A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液中还含有 Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的若干种,现取100mL 该溶液进行实验(不考虑实验操作过程中物质质量的损失,忽略溶液体积变化):①向该溶液中通入过量氯气,充分反应后加入CCl4进行萃取分液,得到水层和紫色有机层;②向实验①得到的水层,加入足量的NaOH溶液,产生沉淀,过滤,得到的沉淀进行洗涤、灼烧后得到1.60g固体;③向实验②所得滤液中加入硝酸银溶液和稀硝酸,产生白色沉淀;④向实验①所得到的紫色有机层,进行一系列操作后,得到2.54g紫黑色固体。根据实验结果,下列判断正确的是
A.不能确定Na+和Cl-是否存在,CO32-一定不存在
B.Fe2+、I-、Cl-三种离子一定存在
C.Fe3+、Fe2+至少有一种
D.该溶液中c(Cl-)≥0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH的电离常数K=1.6×10-5。向20mL0.01mol·L-1 CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
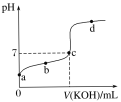
(1)写出CH3COOH的电离方程式___;
(2)c点时,所加氢氧化钾溶液的体积___20ml(填“>”“<”或“=”),b、d两点水的离子积常数的关系为kw(b)___kw(d)(填“>”“<”或“=”),滴定过程中宜选用___作指示剂,滴定终点在___(填“c点以上”或“c点以下”)。
(3)a点溶液中c(H+)约为___。
(4)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是____(填字母)。

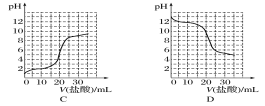
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,当反应aA(g) ![]() bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与下图对应的是( )




A.对于达到平衡状态的N2(g) + 3H2(g) 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动
B.由图②可知,p2 > p1,T1 > T2满足反应:2A(g) + B(g) 2C(g) ΔH < 0
C.图③表示的反应方程式为2A = B + 3C
D.对于反应2X(g) + 3Y(g) 2Z(g) ΔH < 0,图④y轴可以表示Y的百分含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com