
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是
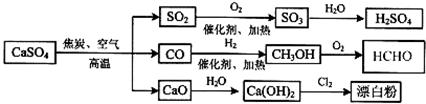
A.CO、SO2、SO3均是酸性氧化物
B.除去与水反应,图示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4。则下列判断正确的是
A.元素电负性:按X、Y、Z变小
B.含氧酸的酸性:H3ZO4>H2YO4>HXO4
C.气态氢化物稳定性:按X、Y、Z顺序增加
D.非金属性:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)某溶液中只含有K+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,回答下列问题:
①该反应中的氧化剂是_______________。
②用单线桥表示此反应转移的电子数目及方向。
_______________________________________________
③若氧化产物比还原产物多1.75 mol,上述反应转移的电子数目为 。
(3)镁、铝合金3 g与100 mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4 g,则原硫酸溶液的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如下图),每次实验时,通过灵敏电流计测出电子流动方向如下:
|
| 所用金属 | 电子流向 |
| ① | A、Cu | A→Cu |
| ② | C、D | D→C |
| ③ | A、C | C→A |
| ④ | B、Cu | Cu→B |
| ⑤ | …… | …… |
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序是_____________________________。
(2)在①中,Cu片上观察到的现象是:_____________________________;
(3)在②中,溶液中H+向金属片________移动;
(4)在④中,两金属片上均无气泡放出。此时两金属片上的电极反应式分别为:
Cu:____________________________;B:_____________________________;
(5)如果实验⑤用B、D,则导线中电流方向为:_________(填B→D或D→B);
(6)已知反应:Cu+2Fe3+==Cu2++2Fe2+。请用下列试剂和材料,用上图所示装置,将此反应设计成原电池并检验正极产物。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、K3[Fe(CN)6]溶液、双氧水、NaOH溶液
材料:Cu片、Fe片、石墨棒
a、设计电池应选用的试剂和材料是:__________________________________;
b、检验正极产物选用的试剂是_______________________,检验反应的离子方程式:
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.胶体区别于其他分散系的本质特征是分散质微粒直径在1 nm~100 nm之间
B.NH3的沸点高于PH3,是因为N-H键能大于P-H键能
C.金属阳离子只存在于离子晶体中
D.由非金属元素组成的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
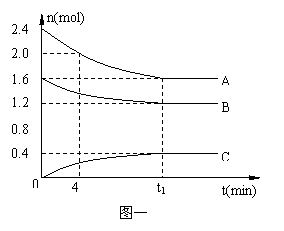
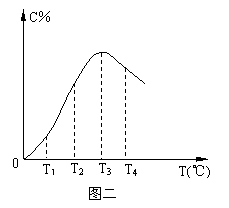
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
 | |||
 | |||
下列分析不正确的是:
A.0~4分钟时,A的平均反应速率为0.02mol/(L?min)
B.该反应的平衡常数表达式K=
C.由T1向T2变化时,正反应速率大于逆反应速率
D.此反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ 碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g)  WI2(g)
WI2(g)
为模拟上述反应,在实验室中准确称
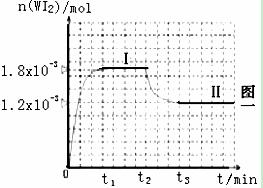 取0.508 g 碘、0.736 g金属钨放置于50.0
取0.508 g 碘、0.736 g金属钨放置于50.0
mL密闭容器中,并加热使其反应。右图一
是混合气体中的WI2蒸气的物质的量随时
间变化关系的图像[n(WI2) ~ t],其中
曲线Ⅰ(0~t2时间段)的反应温度为450℃,
曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
请回答下列问题:
(1)该反应是 (填写“放热”“吸热”)反应。
(2)反应从开始到t1(t1= 3 min)时间内的平均速率υ(I2)= mol/(L.min)。
(3)在450℃时,计算该反应的平衡常数K= 。
(4)能够说明上述反应已经达到平衡状态的有 。
A.I2与WI2的浓度相等
B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
 C.容器内混合气体的密度不再增加
C.容器内混合气体的密度不再增加
D.容器内气体压强不变化
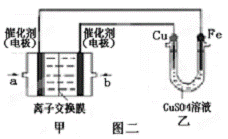
Ⅱ 图二中甲为甲醇燃料电池(电解质溶
液为KOH溶液),该同学想在乙中实
现铁上镀铜,则a处电极上发生的电
极反应式是 。
Ⅲ 已知:H2(g)、CO(g)和CH3CH2OH(l)的燃烧热
分别为285.8 kJ·mol-1、283.0 kJ·mol-1和1365.5 kJ·mol-1。
反应 2CO(g)+4H2(g) CH3CH2OH(l)+H2O(l) 的△H= 。
CH3CH2OH(l)+H2O(l) 的△H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将12.8gMg、Al、Fe组成的合金溶于足量的NaOH溶液中,可产生0.3mol气体。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,其质量为38.3g,则上述反应中生成NO气体的体积(标准状况下)为( )
A. 11.2L B. 33.6L C. 22.4L D.6.72L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com