
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
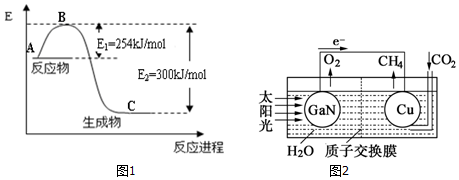
 ;
;分析 (1)据焓变等于反应物活化能减去生成物活化能求算焓变,再书写热化学方程式;
(2)根据反应热等于反应物的总键能减去生成物的总键能计算;
(3)①原电池中电子从负极流向正极,则Cu电极为正极,正极上CO2得电子生成CH4;
②根据溶液中的电解质的酸碱性判断;
(4)①肼是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键;
②NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
③已知ⅠN2(g)+2O2(g)=N2O4 (g)△H1=-19.5kJ/mol
ⅡN2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.2kJ/mol;
利用盖斯定律将Ⅱ×2-Ⅰ可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),并以此计算反应热.燃料电池中,燃料在负极失电子发生氧化反应,④N2H4失电子生成N2,据此分析书写.
解答 解:(1)据焓变等于反应物活化能减去生成物活化能求算焓变,N2和H2反应生成2mol NH3过程中的△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,所以热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(2)反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则943KJ/mol+3×435KJ/mol-6x=-92KJ/mol,x=390KJ/mol,
故答案为:390KJ/mol;
(3)①原电池中电子从负极流向正极,则Cu电极为正极,正极上CO2得电子生成CH4,则铜电极表面的电极反应式为:CO2+8e-+8H+=CH4+2H2O;
故答案为:CO2+8e-+8H+=CH4+2H2O;
②电解质溶液显酸性,加氢氧化钠能与二氧化碳反应,所以不能加NaOH,应该加硫酸;
故答案为:硫酸;
(4)①联氨是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键,结构式为: ,
,
故答案为: ;
;
②NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
③已知ⅠN2(g)+2O2(g)=N2O4 (g)△H1=-19.5kJ/mol
ⅡN2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.2kJ/mol;
利用盖斯定律将Ⅱ×2-Ⅰ可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),
△H=(-534.2kJ/mol)×2-(-19.5kJ/mol)=-1048.9kJ/mol,
故答案为:2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
④肼--空气燃料电池是一种碱性电池,该电池放电时,负极是肼燃烧生成氮气和水,负极的电极反应式为:N2H4-4e-+4OH-=N2+4H2O,
故答案为:N2H4-4e-+4OH-=N2+4H2O.
点评 本题考查反应热的计算、化学电源新型电池,题目难度中等,注意盖斯定律的应用,明确原电池原理为解答关键,注意正确判断电极反应、电子流向、离子流向,难点是电极反应式的书写.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
 ,-C15H27为链烃基,则漆酚不应具有的化学性质是( )
,-C15H27为链烃基,则漆酚不应具有的化学性质是( )| A. | 可以跟FeCl3溶液发生显色反应 | B. | 可以使酸性KMnO4溶液褪色 | ||
| C. | 可以跟Na2CO3溶液反应放出CO2 | D. | 可以发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
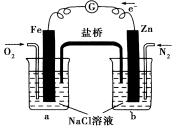
| A. | 烧杯b中发生还原反应 | |
| B. | 烧杯b中发生的反应为2Cl--2e-═Cl2↑ | |
| C. | 烧杯a中发生的反应为2H++2e-═H2↑ | |
| D. | 烧杯a中的溶液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
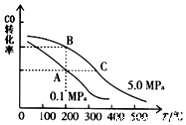 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
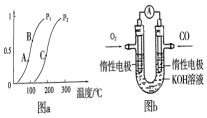 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
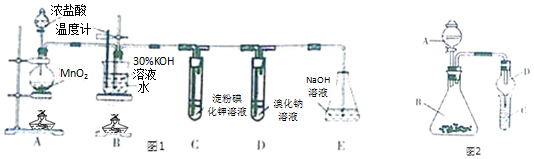
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com