
【题目】胶体与溶液的本质差异在于( )
A.是否稳定、透明B.是否有颜色
C.分散质直径是否介于1-100 mmD.是否具有丁达尔效应
科目:高中化学 来源: 题型:
【题目】将4种金属分别加入到4支装有稀盐酸的试管中,记录的现象如下表所示,正确的是
选项 | 加入的金属 | 是否有气体产生 |
A | 铜 | 有 |
B | 铁 | 有 |
C | 铝 | 无 |
D | 镁 | 无 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为( )
A. Ag++e—===Ag
B. Cu-2e—===Cu2+
C. Cu2++2e—===Cu
D. 2H++2e—===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,H2SO4作为电解质。下列关于该燃料电池的叙述正确的是 ( )
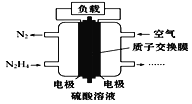
A. 电流从左侧电极经过负载后流向右侧电极
B. 该燃料电池正极发生的电极反应式为N2H4-4e-N2↑+4H+
C. 利用该燃料电池工业上可以电解熔融MgCl2 制备Mg
D. 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2﹣)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( ) 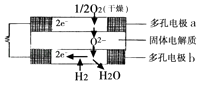
A.该电池的总反应方程式为:2H2+O2=2H2O
B.电子由a极流向b极
C.a极对应的电极反应式为2H2O+O2﹣4e=4OH﹣
D.有O2参加反应的a极为电池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某锂离子电池工作原理如下图所示,电池反应为:Li1-xCoO2+LixC![]() LiCoO2+C。下列说法不正确的是
LiCoO2+C。下列说法不正确的是
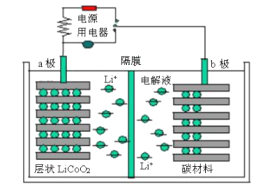
A. 放电时,电子从b极经用电器流向a极
B. 放电时,若转移1mol e-,碳材料将增重7 g
C. 充电时,锂离子通过隔膜进入右室
D. 充电时,a极反应:LiCoO2-xe-= Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙是三种常见的单质,A、B、C是三种常见的二元无机化合物,它们之间的转化关系如右图所示。请回答下列有关问题:
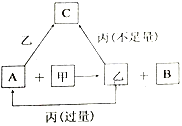
(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为___________。
②丙元素在元素周期表中的位置是___________。
③反应A+甲→乙+B的离子方程式为______________________。
④请简述B中阳离子的检验方法__________________________________。
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为___________。
②A的电子式为___________。
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a_______b(填“>”、“=”或“<")。若溶液X为图中曲线上任意一点,则向溶液X中逐滴加入盐酸至反应完全,消耗盐酸的物质的量最大为___________。
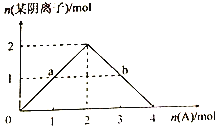
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C、D、E、G均为元素周期表前四周期元素,原子序数依次增大。A 元素原子核外电子分占3 个不同能级,且每个能级上排布的电子数相同;B 元素的简单气态氢化物与最高价氧化物的水化物反应生成盐;C 元素为非金属元素且基态原子的p 能级上电子数比s能级上电子数多1;D元素的原子序数等于B、C两元素原子序数之和,E 是前四周期元素中基态原子中含单电子数最多的元素;G元素位于周期表第11纵行。
(1)E属于____区的元素,其基态原子的核外电子排布式为_____________________。
(2)五种元素中,电负性最大的是__________________(填元素符号)。
(3)B与其同周期相邻元素第一电离能由大到小的顺序为____________________(用元素符号表示)。
(4)下图是已经合成的最著名的“D-B”化合物的分子结构。“D-B”化合物在研磨或迅速加热时会剧烈分解并引起爆炸,生成非常稳定的两种单质分子(相对分子质量之比为7:64),发生反应的化学方程式为____________。
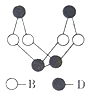
(5)A 元素的最高价含氧酸根离子( 只含A 和氧两种元素)的空间构型为__________________,该酸根离子的中心原子的轨道杂化类型为________________________,与该酸根离子互为等电子体的一种分子为______(填化学式)。
(6)已知G 与C1元素的某种化合物的晶胞结构如图所示: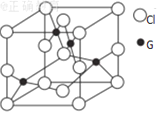 则该化合物的化学式是__________,若G 与Cl原子最近的距离为a cm,则该晶体的密度为_________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
则该化合物的化学式是__________,若G 与Cl原子最近的距离为a cm,则该晶体的密度为_________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com