
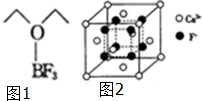
 氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
氟及氟产品在工农业生产中应用非常广泛,回答下列问题: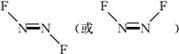 .
.分析 (1)原子核外含有多少电子,核外电子的运动状态就有几种;氟原子含有s和p两种类型的轨道,则电子云有2种;氟原子最外层为L层,含有7个电子,据此写出外围电子排布式;
(2)NaHF2中含有离子键、共价键,F的电负性较强,还存在氢键;
(3)N2F2(二氟氮烯)分子中存在氮氮双键和两个N-F键,据此画出其结构式,在根据N原子形成的σ键数目判断杂化类型;
(4)根据三氟化硼乙醚的熔点、沸点大小进行判断其晶体类型;
(5)①根据图示的晶胞结构判断钙离子、氟离子的配位数;
②该晶胞为立方体结构,根据棱长计算出该晶胞体积,再结合ρ=$\frac{m}{V}$计算出氟化钙晶体的密度.
解答 解:(1)基态氟原子核外含有9个电子,则其核外电子的运动状态有9种;氟原子核外含有2s轨道和p轨道两种轨道,则氟原子的电子的电子云形状有2种;氟原子的外围含有7个电子,其外围电子排布式为:2s22p5,
故答案为:9;2;2s22p5;
(2)NaHF2为离子化合物,存在离子键,H-F键为共价键,F的电负性较强,还存在氢键,
故答案为:离子键、共价键、氢键;CO2(或Na2O);
(3)N2F2(二氟氮烯)分子中,氮原子形成了3个σ键和1个π键,则其杂化轨道类型为sp2;N2F2可能的结构式为: ,
,
故答案为:sp2; ;
;
(4)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,其熔沸点降低,应该属于分子晶体,
故答案为:分子;
(5)①在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4,
故答案为:8;4;
②该晶胞中含有钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氟离子在该晶胞的内部,所以氟离子个数是8,该晶胞中含有4个CaF2,该晶胞的体积为:V=(5.55×10-6)3cm3,该晶胞的密度为:ρ=$\frac{m}{V}$=$\frac{4×78}{{N}_{A}•({5.55×1{0}^{-6})}^{3}}$,
故答案为:ρ=$\frac{4×78}{{N}_{A}•({5.55×1{0}^{-6})}^{3}}$.
点评 本题考查了晶胞计算,题目难度中等,涉及原子核外电子排布、原子轨道杂化方式及杂质类型、晶胞结构及计算等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学计算能力,注意掌握晶胞的结构及计算方法,明确原子核外电子排布规律及原子轨道杂化类型的判断方法.


科目:高中化学 来源: 题型:解答题
 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2: .
. +3NaOH
+3NaOH CH3COONa+2H2O+
CH3COONa+2H2O+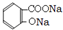 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
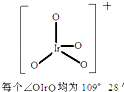
| A. | Ir元素是第六周期第Ⅷ族的金属元素 | |
| B. | IrO4+中Ir的氧化数(即化合价)为+9价 | |
| C. | 在[Ir(CO)3]3-中存在极性键 | |
| D. | IrO4失去1个e-生成IrO4+,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ADI(添加剂每日允许摄量)是衡量食品添加剂安全性的依据,值越高安全性就越高 | |
| B. | API(空气污染指数)是衡量空气质量好坏的重要指标,其值越大,空气质量就越好 | |
| C. | SPF是防晒霜对紫外线的防晒系数,其值越低,对紫外线的防护效果越好 | |
| D. | OTC是非处方药的简称.处方药是由医生选择的药物,所以它比非处方药安全系数大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
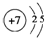 ,C元素在周期表中的位置第三周期ⅥA族.
,C元素在周期表中的位置第三周期ⅥA族. 或
或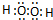
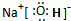
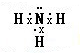
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该溶液中一定含有CO32- | |
| B. | 除去HNO3溶液中的少量H2SO4,可加适量BaCl2溶液 | |
| C. | 利用焰色反应可以将NaCl和KCl两种无色溶液鉴别出来 | |
| D. | 某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
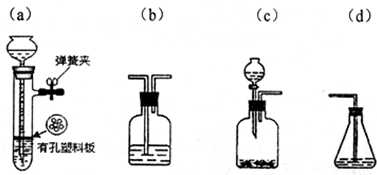
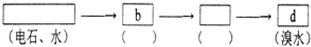
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com