
| 化学事实 | 类推结论 | |
| A | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧也生成Fe2O3 |
| B | pH=3的盐酸稀释1000倍后pH=6 | pH=6的盐酸稀释1000倍后pH=9 |
| C | 用电解熔融MgCl2的方法冶炼金属镁 | 用电解熔融NaCl的方法制取金属钠 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A、A | B、B | C、C | D、D |
| ||
| ||


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
131 52 |
131 52 |
A、与
| ||
| B、中子数为53 | ||
| C、质子数为78 | ||
| D、核外电子数为131 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应既是置换反应,又是氧化还原反应 |
| B、Cl2是氧化剂,发生还原反应 |
| C、Br2是氧化产物 |
| D、钠元素在反应中价态不变,所以NaBr既不是氧化剂,又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl |
| B、2NH3+CO2=2H2O+CO(NH2)2 |
| C、8NH3+3Cl2=N2+6NH4Cl |
| D、NH3+HCl=NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲烷中的氢原子被氯原子完全取代,需要Cl2分子数为2NA |
| B、1mol铁参加化学反应,失去的电子数为3NA |
| C、标准状况下,22.4L乙烯中含有的共价键数为6NA |
| D、常温常压下,100g98%的硫酸溶液中所含的氧原子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
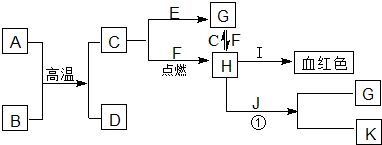
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com