
(6分)取22.1g碳酸钠和碳酸氢钠的混合粉末样品,将其分成两等份,取其中一份加热到质量不再改变,冷却后称其质量为7.95g;另一份溶于水,配成600mL溶液。试计算(计算结果用小数形式表示):
(1)原样品中碳酸钠的物质的量为多少?
(2)所配溶液中Na+的物质的量浓度为多少?
(6分)解:(1) 2NaHCO3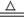 Na2CO3+CO2↑+H2O ............................(1分)
Na2CO3+CO2↑+H2O ............................(1分)
2mol 44g+18g=62g
n( NaHCO3) 11.05g-7.95g=3.1g
n( NaHCO3)=0.1mol
∴原样品中m(NaHCO3)="0.2mol×84g/mol=16.8g" .....................(1分)
m(Na2CO3)=22.1g-16.8g=5.3g
n(Na2CO3)= 0.05mol………………….(1分)
(2)由(1)可知一份中n( NaHCO3)="0.1mol " n(Na2CO3)= 0.025mol
∴n(Na+)="0.1mol+0.025mol×2=0.15mol..................." (1分)
∴c(Na+)=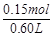 ="0.25" mol·L-1......................(2分)
="0.25" mol·L-1......................(2分)
解析


科目:高中化学 来源: 题型:
(6分)取22.1g碳酸钠和碳酸氢钠的混合粉末样品,将其分成两等份,取其中一份加热到质量不再改变,冷却后称其质量为7.95g;另一份溶于水,配成600mL溶液。试计算(计算结果用小数形式表示):
(1)原样品中碳酸钠的物质的量为多少?
(2)所配溶液中Na+的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源:2014届浙江省台州市高一上学期期末考试化学试卷 题型:计算题
(6分)取22.1g碳酸钠和碳酸氢钠的混合粉末样品,将其分成两等份,取其中一份加热到质量不再改变,冷却后称其质量为7.95g;另一份溶于水,配成600mL溶液。试计算(计算结果用小数形式表示):
(1)原样品中碳酸钠的物质的量为多少?
(2)所配溶液中Na+的物质的量浓度为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com