

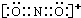 ,基态Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,
,基态Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,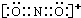 ; 1s22s22p63s23p63d104s1;
; 1s22s22p63s23p63d104s1;| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应是放热反应 |
| B、A不是气态物质,加入A该平衡向正反应方向移动 |
| C、其他条件不变,加入A平衡不移动 |
| D、改变压强对该平衡的移动无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| x |
| 2 |
| x |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
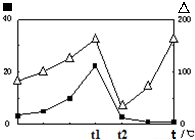 (14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
(14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B、鸡蛋清中加入CuSO4溶液产生盐析 |
| C、乙酸乙酯、油脂与NaOH溶液反应均有乙醇生成 |
| D、石油分馏可得到汽油、煤油等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com