
| A. | 常温,NaHCO3溶解度比Na2CO3小,向饱和Na2CO3溶液中通入CO2产生沉淀 | |
| B. | 常温,SiO2与氢氟酸、NaOH溶液均可反应,SiO2是两性氧化物 | |
| C. | BaSO3难溶于水,SO2气体通入Ba(NO3)2溶液中产生沉淀 | |
| D. | 非金属性:Cl>S,酸性:HClO>H2SO4 |
分析 A.由溶解度可分析饱和溶液晶体析出的原因,NaHCO3溶解度比Na2CO3小;
B.SiO2与氢氟酸反应不生成盐和水;
C.SO2气体通入Ba(NO3)2发生氧化还原反应生成BaSO4沉淀;
D.非金属性:Cl>S,可比较最高价氧化物水化物的酸性;
解答 解:A.由溶解度可NaHCO3溶解度比Na2CO3小,向饱和Na2CO3溶液中通入CO2产生沉淀碳酸氢钠,陈述Ⅰ和Ⅱ均正确,并存在因果关系,故A选;
B.SiO2与氢氟酸反应不生成盐和水,虽然SiO2既能与氢氟酸反应又能与NaOH溶液反应,但是SiO2不是两性氧化物,是酸性氧化物,故B不选;
C.SO2气体通入Ba(NO3)2发生氧化还原反应生成BaSO4沉淀,陈述Ⅰ和Ⅱ均正确,但不存在因果关系,故C不选;
D.非金属性:Cl>S,可比较最高价氧化物水化物的酸性,陈述Ⅰ正确,Ⅱ错,不存在因果关系,故D不选;
故选A.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及相关反应原理为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+具有氧化性,Fe2+具有还原性 | |
| B. | Fe3+的水溶液呈红褐色,Fe2+的水溶液呈浅绿色 | |
| C. | Fe2+的溶液中滴入强碱溶液,立即出现红褐色沉淀 | |
| D. | 铁可以在氧气中燃烧生成Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
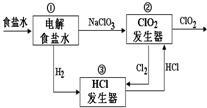 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
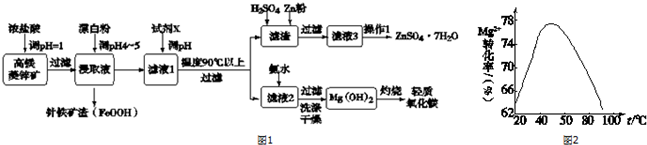
| Zn2+ | Mg2+ | Cu2+ | Fe3+ | Fe2+ | |
| 开始沉淀pH | 5.9 | 9.4 | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 8.2 | 12.4 | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂,向海水中加入明矾可以使海水淡化 | |
| B. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| C. | 臭氧是一种氧化性较强的气体,可用于自来水的消毒 | |
| D. | SO2具有还原性,可用已知浓度的KMnO4溶液测定食品中SO2残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
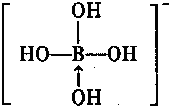 .(若存在配位键需标出)
.(若存在配位键需标出)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
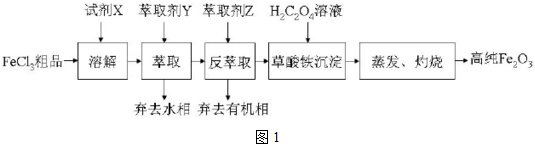
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
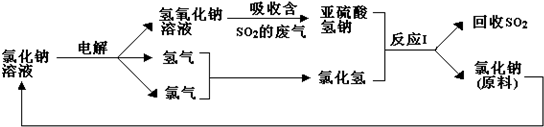
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com