
【题目】
对甲苯丙烯酸甲酯 (E)是一种用于合成抗血栓药的中间体,其合成路线如下:
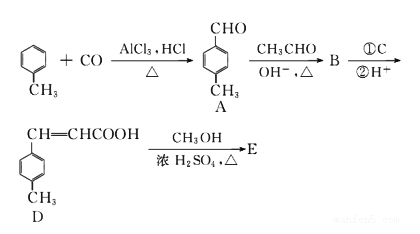
已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)A中官能团的名称为_______,A分子中核磁共振氢谱各峰值比为________。
(2)物质B的结构简式为_______,生成E的反应类型为__________。
(3)试剂C可选用下列中的_________。
a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(4)![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________。
(5)遇FeCl 3溶液显紫色,且苯环上有两个取代基的A的同分异构体有______种,E在一定条件下可以生成高聚物F,F的结构简式为__________。
【答案】 醛基 1 : 2 : 2 : 3 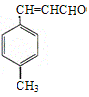 取代反应(或酯化反应) b、d
取代反应(或酯化反应) b、d 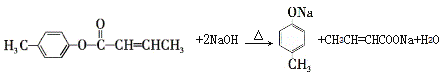 3
3 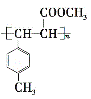
【解析】由合成路线可知,甲苯发生取代反应生成对甲基苯甲醛,再与CH3CHO在碱性条件下反应生成B,B为: 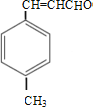 ,①中-CHO被弱氧化剂氧化为-COOH,而C=C不能被氧化,再酸化得到D:
,①中-CHO被弱氧化剂氧化为-COOH,而C=C不能被氧化,再酸化得到D: 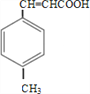 , D与甲醇发生酯化反应生成E为:
, D与甲醇发生酯化反应生成E为: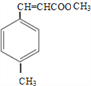 。
。
(1)A为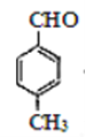 ,含有的官能团是醛基,它的等效氢在醛基上为一种,苯环是有二种,甲基是有一种,核磁共振氢谱各峰值比1 : 2 : 2 : 3。
,含有的官能团是醛基,它的等效氢在醛基上为一种,苯环是有二种,甲基是有一种,核磁共振氢谱各峰值比1 : 2 : 2 : 3。
(2)B为 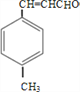 ,生成E的反应类型为 酯化反应(取代反应)。
,生成E的反应类型为 酯化反应(取代反应)。
(3)B中含有的醛基与C反应转化为羧基,所以试剂C可以为银氨溶液或新制Cu(OH)2悬浊液。
(4)酯基在NaOH条件下发生水解反应,根据水解反应,的原理可写成化学方程式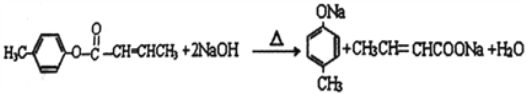 。
。
(5)遇FeCl3 溶液显紫色,说明同分异构体含有酚羟基,则另一个取代基为乙基,二者可为邻、间、对3种位置,共有3种同分异构体;E中含有碳碳双键,经过加聚反应可得E,根据加聚反应规律可得F的结构简式 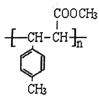 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.元素的第一电离能越大,其金属性一定越强
B.元素的第一电离能越小,其金属性一定越强
C.同主族元素的单质从上到下,金属性增强,熔点升高
D.金属单质与酸反应越容易,其元素的电负性越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制245 mL 1.2 mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制245 mL 1.2 mol/L的NaOH溶液,需用托盘天平称取NaOH______g,所需的玻璃仪器有量筒、烧杯、______________________________________。
(2)容量瓶上需标有以下五项中的_____________________。(填序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)在定容操作时,应将蒸馏水注入容量瓶,液面离容量瓶颈刻度线______________处,改用____________滴加蒸馏水至与刻度线相平。盖好瓶塞,反复颠倒摇匀。
(4)本实验中,下列配制的溶液浓度偏低的是_____________。 (填字母代号)
A.称量NaOH时,使用游码,砝码错放在左盘
B.向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C.定容时仰视观察液面
D.溶解后未冷却到室温就将溶液转移到容量瓶中
E.配制前,容量瓶中有少量蒸馏水
(5)下列关于容量瓶的使用方法和操作的描述,正确的是___________。(填字母代号)
A.使用容量瓶前检查它是否漏水
B.引流时,玻璃棒的下端应在容量瓶刻度线以上
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,定容至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水定容至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)金属冶炼和处理常涉及氧化还原反应。
(1)如图为电解精炼银的示意图,__________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为___________。
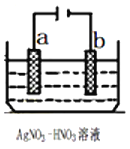
(2)为处理银器表面的黑斑(Ag2S),可将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,该过程依据的是电化学中的_________原理(填“原电池”或“电解池”),食盐水的作用为________。
(二)FeCl3具有净水作用,但腐蚀设备,所以工业上常选用电浮选凝聚法处理污水.其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.某课外小组用电浮选凝聚法处理污水,设计如图所示装置示意图。
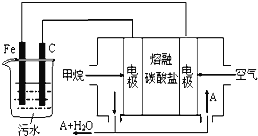
(3)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ_______________,Ⅱ_______________。
(4)该燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极,负极电极反应式为______________。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是( )
①离子化合物可以含共价键②共价化合物可能含离子键 ③离子化合物中只能含离子键 ④共价化合物中不含离子键 ⑤共价化合物只含共价键⑥共价化合物可能含极性键和非极性键
A. ①④⑤⑥ B. ①③⑥ C. ②③④⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为______________;
②该反应的热化学方程式为________________________________;
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=____________kJ·mol-1;
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
(3)倒入NaOH溶液的正确操作是_______________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是_________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:___________。(任意写出一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要化工原料CuSO4的制备途径及性质如图所示。下列说法错误的是
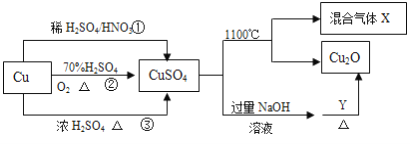
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. Y物质具有还原性,可以是葡萄糖
D. 1molCuSO4在1100℃所得混合气体X中O2一定为0.75mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com