
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 金属导电的实质是金属阳离子在外电场作用下的定向移动 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2 |
分析 A、金属原子中的最外层电子在晶体中为自由电子,而不是所有的核外电子;
B、金属导电的实质是金属阳离子和自由电子的定向移动,产生电流;
C、金属原子在化学变化中失去的电子数多少和还原性无关;
D、利用均摊法来计算原子的个数.
解答 解:A、因金属的最外层电子受原子核的吸引小,则金属原子中的最外层电子在晶体中为自由电子,故A错误;
B、金属导电的实质是金属阳离子和自由电子定向移动而产生电流的结果,故B错误;
C、金属原子在化学变化中失去电子越容易,其还原性越强,故C错误;
D、体心立方晶胞中原子在顶点和体心,则原子个数为1+8×$\frac{1}{8}$=2,面心立方晶胞中原子在顶点和面心,原子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,原子的个数之比为2:4=1:2,故D正确.
故选D.
点评 本题考查学生金属晶体中的微粒以及导电的原理知识,学会用均摊法计算,注意知识的归纳和梳理是关键,难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
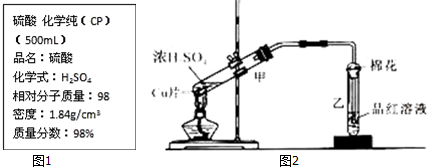
 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 | |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3=2H++CO32- | |
| B. | F-的结构示意图: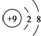 | |
| C. | ${\;}_{55}^{134}$Cs和${\;}_{55}^{137}$Cs形成的单质物理性质相同 | |
| D. | NH3 的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
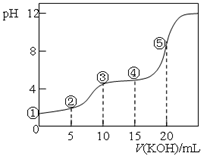 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| C. | 点③所示溶液中:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05mol•L-1 | |
| D. | 点⑤所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
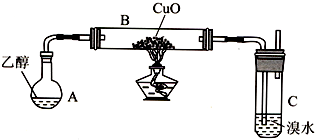
| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com