
某溶液可能含有Cl-、SO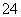 、CO
、CO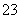 、NH
、NH 、Fe3+、Al3+和K+。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
、Fe3+、Al3+和K+。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
A、至少存在5种离子 B、Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C、SO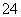 、NH
、NH 一定存在,Cl-可能不存在 D、CO
一定存在,Cl-可能不存在 D、CO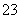 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
【知识点】离子推断 计算A3 A4 B1 C5 D5
【答案解析】B解析:由于加入过量NaOH溶液,加热,得到0.02mol气体,说明一定有NH4+,且物质的量为0.02mol,同时产生红褐色沉淀,说明一定有Fe3+,1.6g固体为氧化铁,物质的量为0.01mol,则有0.02molFe3+,根据共存知一定没有CO32-;4.66g不溶于盐酸的沉淀为硫酸钡,则溶液中一定有SO42-,物质的量为0.02mol; 根据电荷守恒,一定有Cl-,至少 0.02mol×3+0.02-0.02mol×2
=0.04mol,物质的量浓度至少 0.4mol/L,因此A、C错误;B正确;Al3+无法判断是否存在,D错误。
【思路点拨】根据现象判断可能存在的离子,再根据电荷守恒分析判断存在的其他离子。


科目:高中化学 来源: 题型:
绿色化学概念从一提出来,就明确了它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节都实现净化和无污染的反应途径。下列化工生产中体现绿色化学内涵的是
( )。
①减少“三废”排放量
②考虑有关原材料的再生利用
③出现污染问题再治理
④回收未反应的原料、副产物、助溶剂、稳定剂等非反应试剂
⑤拒绝使用无法替代、无法回收、无法再生和重复使用的有毒副作用、污染明显的原料
A.①③④ B.①②③⑤
C.①②④⑤ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
烷烃分子可看成是由—CH3、—CH2—、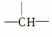 和
和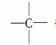 等结构组成的。如果某烷烃分子中同时存在这4种结构,所含碳原子数又最少,这种烷烃分子应含____________个碳原子,其结构简式可能为________________________或__________________或
等结构组成的。如果某烷烃分子中同时存在这4种结构,所含碳原子数又最少,这种烷烃分子应含____________个碳原子,其结构简式可能为________________________或__________________或
____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+C02↑
B.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+ BaSO4↓
C.硫酸工业尾气中的SO2用过量的氨水吸收:2NH3·H2O+ SO2 =2NH4++ SO32-+H2O
D.Cu溶于浓HNO3:Cu+ 4H++ 2NO3一=Cu2++ 2NO↑+ 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A. 铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 碳酸镁中滴加稀盐酸:CO32—+2H+ =CO2↑ + H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.Cu溶于稀HNO3:Cu+2H++NO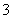 ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.NaHCO3溶液中加入稀盐酸:CO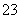 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO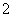 +4NH
+4NH +2H2O
+2H2O
D.向NaAlO2溶液中通入过量CO2制Al(OH)3: CO2+AlO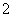 +2H2O===Al(OH)3↓+HCO
+2H2O===Al(OH)3↓+HCO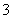
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示化学反应的离子方程式,其中正确的是
A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3
B.氯气通入冷水中:Cl2+H2O 2H++Cl- +ClO-
2H++Cl- +ClO-
C.苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O =2C6H5OH +CO32-
D.FeCl3溶液与Cu反应:2Fe3++Cu = 2Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水中可能含有如下几种阴阳离子:
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al + X + OH- =AlO2-+ NH3 + N2 +
该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1,3丁二烯之间能够发生与1,4加成相似的聚合反应。写出下面的有机物发生聚合反应的化学方程式。
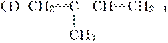
(2)1,3丁二烯和苯乙烯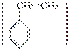 按物质的量之比1∶1发生加聚反应。
按物质的量之比1∶1发生加聚反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com