
【题目】某同学在家中进行化学实验,按照图1连接好线路后发现灯泡不亮,按照图2连接好线路后发现灯泡亮,由此得出的结论正确的是
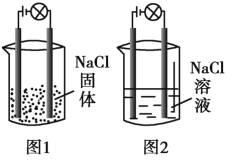
A. NaCl固体中没有离子
B. 图2中NaCl在电流的作用下电离出大量的离子
C. NaCl溶液中水电离出大量的离子
D. 图2工作时发生了氧化还原反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下
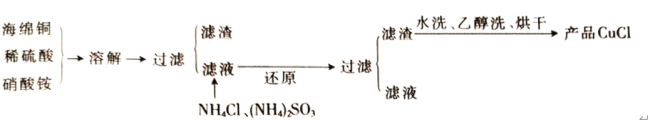
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:_________
Cu+ NO3-+ = Cu2++ NO↑+ H2O
(2)“还原”过程中,作还原剂的是__________(填化学式);写出“还原”过程中发生反应的离子方程式:__________________________________。
(3)写出CuCl在潮湿的空气中被氧化的化学方程式:__________________________。
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图1实验装置进行制取氯酸钾和验证元素的非金属性相对强弱的实验。已知氯气在加热条件下与氢氧化钾反应生成氯酸钾、水和氯化钾。
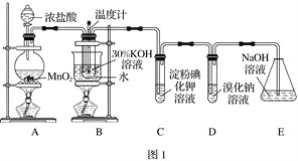
(1)A装置中反应的离子方程式为_______,B装置中反应的离子方程式为_______,B装置采用水浴加热的优点是_______。
(2)若对调B和C装置的位置,_____(填“能”或“不能”)提高B中氯酸钾的产率。
(3)验证非金属性:Cl>I的实验现象是_______,该装置______(填“能”或“不能”)验证非金属性:Cl>Br>I。
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入_____,C中反应的化学方程式:_____,D装置的作用是______。
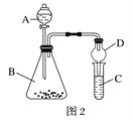
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO45H2O)和副产物石膏(CaSO42H2O)的生产流程示意图:
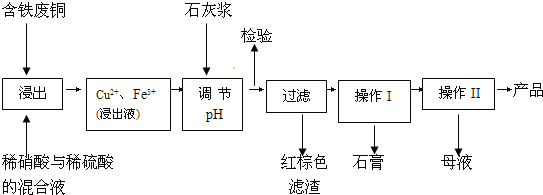
胆矾和石膏在不同温度下的溶解度(g/100g水)见表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是___;
(2)写出浸出过程中生成硫酸铜的离子方程式___;
(3)操作I包括蒸发浓缩、__等操作,温度应该控制在__℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为__、___、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__;干燥时采用晾干,不用加热烘干的原因是___。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是__;
②指出你认为不合理方案存在的问题是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业上以铝土矿(含有Al2O3、Ga2O3、SiO2等物质)为原料提取Al2O3(熔点2045℃),并将Al2O3和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
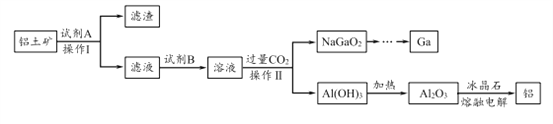
(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式 ___________________。
(2)操作I得到滤渣的主要成分有________________ 。
(3)将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为 ________________ ;该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质,原因是 _________________________。
(4)饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________ ,此方法的缺点是处理后的水中生成了AlO2-,仍然可能对人类健康产生危害,还需对该饮用水进行一系列后续处理。已知:25℃时,Ksp[Al(OH)3]=1.3×10-33,Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=____,此时水中
AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=____,此时水中![]() =__________。
=__________。
(5)工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。
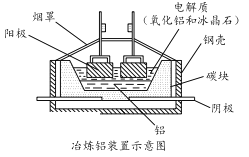
①阴极电极反应式为________________________ 。
②工业生产中,阳极材料要定期补充,其原因是:____________________。
(6)下列有关推理不合理的是 ______。
a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍在电池和电镀等工业上具有广泛的用途,可镍也具有很强的毒性,若不进行回收处理,将对环境造成很大的影响,以下是以电镀废渣为原料获得NiSO46H2O的过程,已知,废渣中除含金属镍外,主要含有:Cu、Zn、Fe、Mg等元素的化合物。
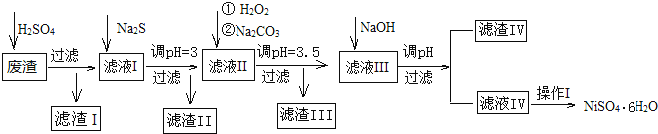
部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
(1)往废渣中加H2SO4酸浸,提高酸浸效率的方法有__(至少写出2点)。
(2)加Na2S同时调溶液的pH为3,目的是除去铜、锌等杂质,则往滤液Ⅱ中加入H2O2的反应的离子方程式为___。
(3)操作Ⅰ包括以下过程:__、__、过滤、洗涤、干燥.该洗涤过程不能用水洗涤,应该用__洗涤,目的是___。干燥有低温干燥和高温干燥,能否用高温干燥___,理由是____。
(4)滤液Ⅲ中加入NaOH溶液的目的是调节溶液的pH为8以除去Al3+以及少量的Mg2+,若向含有Mg2+、Al3+的溶液中滴加NaOH溶液,常温下当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Al3+)=__。{已知:25℃时,Ksp[Mg(OH)2]=5.0×10-14;Ksp[Al(OH)3]=2.0×10-33}。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用失活的含镍催化剂(含NiB、MgO及SiO2等)为原料制备超细镍粉,其工艺流程如下:
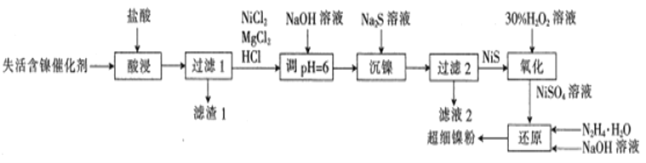
已知:pH=6时,Mg2+、Ni2+都不生成沉淀。
回答下列问题:
(1)非晶态NiB可由KBH4和Ni(NO3)2溶液反应制备。KBH4的电子式为_________
(2)“酸浸”时,为提高镍的浸取率可采取的措施是___________ (列举一点);滤值1中除了含有B单质外,还含有___________ (填化学式)。
(3)若流程中没有“NaOH溶液调pH=6”,则导致的后果是________
(4)“氧化”时发生反应的化学方程式为_______________;氧化时温度不宜超过50℃,其原因是_________________
(5)“还原”时产生无污染的气体,“还原”时发生反应的离子方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4xH2O)在电池工业、制药、照片显影等方面有重要作用。在实验室中用制备草酸亚铁并研究其性质,具体流程如图:
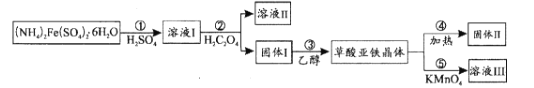
已知:常温下,pH>4时,Fe2+容易被氧化;H2C2O4的Ka1=5.9×10-2,Ka2=6.5×10-5;Ksp(FeC2O4xH2O)=3.2×10-7
回答下列问题:
(1)步骤①用水溶解的过程中,加入少量稀H2SO4的作用是_____。
(2)步骤②中加入的H2C2O4属于_____酸,生成固体I的离子反应方程式为_____。
(3)步骤③中先用水洗涤,再用乙醇洗涤,其目的是_____。
(4)步骤④是检验草酸亚铁晶体加热分解后的产物H2O、CO、CO2,首先检验的气体为_____,然后将剩余气体依次通过_____(填序号,装置可重复使用)→尾气处理。实验前需要将装置中的空气排尽,理由是_____。

(5)步骤⑤采用滴定分析法测定FeC2O4xH2O中x的值。取0.18g样品溶于稀硫酸配成100.00mL溶液,取20.00mL于锥形瓶中,用0.0100molL-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00mL。滴定终点的现象为_____,x值为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com