
| A. | H2O2、K2O2、C2H2 | B. | CaC12、BaO2、MgF2 | ||
| C. | CO2、CS2、KO2 | D. | NH4Cl、NaOH、KHS04 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点由高到低:癸烷、正已烷、新戊烷、正戊烷 | |
| B. | 酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,又可以用来除去甲烷中的少量乙烯 | |
| C. | 乙烯的化学性质比乙烷活泼,可作香蕉等水果的催熟剂 | |
| D. | 苯可以通过石油分馏或煤焦油的催化重整获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑥ | C. | ①④⑤⑦ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
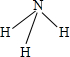 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为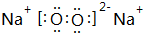 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 各级电离能 | 电离能数值kJ/mol |
| 第一电离能 | 578 |
| 第二电离能 | 1817 |
| 第三电离能 | 2745 |
| 第四电离能 | 11575 |
| 第五电离能 | 14830 |
| 第六电离能 | 18376 |
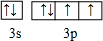 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com