
软锰矿是制备二氧化锰的原料,软锰矿中含有二氧化硅、氧化铜、氧化铁、氧化铝、氧化锌等杂质。工业上以软锰矿为原料制备高纯二氧化锰的工艺流程图如下:
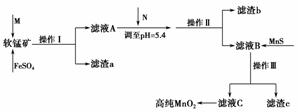
(1)酸性条件下,FeSO4将MnO2还原为MnSO4,那么加入的酸M为________,该反应的离子方程式为______________________________。
(2)制备二氧化锰工艺流程中涉及的阳离子以氢氧化物的形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 10.4 |
由流程图信息和表格中数据可知滤渣b的主要成分是________(填化学式)。调节溶液pH=5.4需加入试剂N,N可以是________。
a.CO2 b.稀硫酸 c.NH3 d.氨水
(3)部分硫化物的溶度积常数(Ksp)如下表:
| 硫化物 | CuS | ZnS | MnS | FeS |
| Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由表格中的数据推知流程图中向滤液B中加入MnS的作用是__________________________________________________________。
科目:高中化学 来源: 题型:
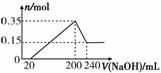
某研究小组将一定质量的镁铝合金材料投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的关系如图所示。
请回答下列问题:
(1)该合金材料中,镁、铝的物质的量之比为______。
(2)硫酸的物质的量浓度为______。
(3)另取相同质量的该合金材料与7.8 g Na2O2一起投入足量的H2O中,最终产生的气体在标准状况下的体积为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。如图表示298.15 K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
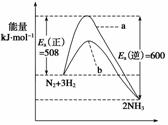
(1)若反应中生成2 mol氨,则反应________(填“吸热”或“放热”)________kJ。
(2)在图中曲线________(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是_____________________________________________________________
________________________________________________________________________。
(3)目前合成氨工业广泛采用的反应条件500℃、20 MPa~50 MPa、铁触媒,反应转化率不超过50%,工业上为了进一步提高氨气产率,你认为下列措施最经济可行的是
________________________________________________________________________。
A.降低反应温度,让反应向着有利于氨气生成的方向进行
B.升高温度,让更多的分子变成活化分子
C.寻求能在更低的温度下有很强催化活性的新型催化剂
D.寻求新型耐高压材料,将压强增大一倍
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.CO2和CH4都是引起“温室效应”的气体
B.Na2O、Na2O2的组成元素相同,故与CO2反应的产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.分别向新制氯水和久置氯水中滴加少量紫色石蕊试液,充分振荡后溶液都呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中,Br2与Na2SO3反应的离子方程式:__________________________________________________________。
(2)反应后,溶液含有SO 、SO
、SO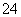 、Br-、OH-等阴离子,下表是某同学鉴定其中SO
、Br-、OH-等阴离子,下表是某同学鉴定其中SO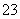 、SO
、SO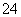 和Br-的实验报告,请完成未填完的部分。
和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1盐酸;1 mol·L-1H2SO4溶液;1 mol·L-1BaCl2溶液;1 mol·L-1Ba(NO3)2溶液;CCl4、新制饱和氯水、品红溶液。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管中,加入过量的2 mol·L-1盐酸,再滴加适量1 mol·L-1BaCl2溶液 | 有白色沉淀生成,证明待测液中含SO |
| 步骤② | ||
| 步骤③ |
(3)为测定上述样品的纯度,该同学取10.0 g试样,配成250 mL溶液,取25.00 mL所配溶液,用0.10 mol·L-1的酸性KMnO4溶液滴定至终点。离子反应为2MnO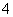 +5SO
+5SO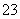 +6H+===2Mn2++5SO
+6H+===2Mn2++5SO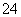 +3H2O,重复操作三次,每次消耗0.10 mol·L-1 KMnO4溶液的体积分别为20.02 mL、20.00 mL和19.98 mL。
+3H2O,重复操作三次,每次消耗0.10 mol·L-1 KMnO4溶液的体积分别为20.02 mL、20.00 mL和19.98 mL。
①该试样中Na2SO3的质量分数为________(结果保留3位有效数字);
②操作时,若未用0.10 mol·L-1的酸性KMnO4溶液润洗滴定管,会导致测定结果________(填“偏高”、“偏低”或“没有影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的打“√”,错误的打“×”
(1)任何温度下,水溶液中c(H+)和c(OH-)的相对大小都可判断溶液的酸、碱性( )
(2)弱电解质的导电能力一定比强电解质的导电能力弱( )
(3)某盐溶液呈酸性,一定是由水解引起的( )
(4)水解方程式都必须写“”( )
(5)AgCl(s)溶解平衡常数表达式为Ksp=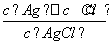 ( )
( )
(6)沉淀转化只能是Ksp大的沉淀转为Ksp小的沉淀( )
(7)中和等体积、等pH的盐酸和醋酸消耗的NaOH的量相同( )
(8)制备无水AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法( )
(9)用湿润的pH试纸测得某溶液的pH=3.4( )
(10)在NaHCO3溶液中加入NaOH,不会影响离子的种类( )
查看答案和解析>>
科目:高中化学 来源: 题型:
现有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1。下列说法正确的是(双选)( )
A.三种溶液的pH大小顺序是③>②>①
B.将三种溶液稀释相同倍数,pH变化最大的是③
C.分别加入25 mL 0.1 mol·L-1的盐酸后,溶液的pH大小顺序是①>③>②
D.三种溶液中,由水电离的c(OH-)大小顺序是③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,0.01 mol·L-1两种弱酸溶液的pH如表。下列说法正确的是( )
| 弱酸 | CH3COOH | HCN |
| pH | 3.4 | 5.6 |
A.相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,CH3COONa溶液的pH较大
C.等体积、相同pH的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH
D.HCN的电离平衡常数(Ka)与CN-的水解平衡常数(K)存在如下关系:Ka·K=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氢氟酸在水溶液中存在如下电离平衡:HFH++F-。只改变一个条件一定可以使 减小的是( )
减小的是( )
A.通入少量氯化氢气体 B.加入少量氟化钾固体
C.加入少量氢氧化钠固体 D.通入少量氟化氢气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com