
| A. | CuSO4 | B. | NaOH | C. | Na2CO3 | D. | CH3COONa |
分析 根据发生的反应为Fe+2H+═Fe2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,以此来解答.
解答 解:A.加入硫酸铜,铁置换出Cu,形成铁铜原电池,加快反应速率,故A错误;
B.加入NaOH,发生酸碱中和反应,减少氢气的生成,故B错误;
C.加入Na2CO3固体,与盐酸反应生成二氧化碳,减少了氢气的生成,故C错误;
D.加入CH3COONa固体,硫酸变为醋酸,氢离子的浓度减小但不能改变氢离子的物质的量,则减慢反应速率,又不影响生成氢气的总量,故D正确.
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、原电池对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaOH和HAC | B. | KOH和HNO3 | C. | Ba(OH)2和H2SO4 | D. | NH3•H2O和HAC |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| B. | PH=3的HClO溶液,加水稀释后,溶液中所有的离子浓度降低 | |
| C. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq);△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 将20ml 1mol/L HClO溶液与10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
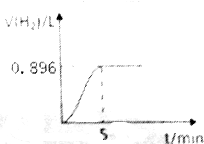 取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:
取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氮气的转化率减小 | |
| B. | 氢气的转化率增大 | |
| C. | 氨气在平衡混合气体中的百分含量一定增大 | |
| D. | 氨气的分解速率大于氨气的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键是阴、阳离子间存在的静电引力 | |
| B. | 只有金属和非金属化合时才能形成离子键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 第ⅠA族和第ⅦA族元素原子化合时,一定形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com