
【题目】下列反应中,属于氧化还原反应的是( )
A.2NaHCO3 ![]() ?Na2CO3+CO2↑+H2O
?Na2CO3+CO2↑+H2O
B.H2SO4+CuO═CuSO4+H2O
C.2 H2S+SO2═3S↓+2H2O
D.CO2+Ca(OH)2═CaCO3↓+H2O
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H<0,下列有关叙述正确的( )
A.上述反应的化学反应速率关系:2 v(NH3)=3 v(H2O)
B.若在2L的密闭容器中反应,经过3min后NH3的物质的量由10mol变为7mol 则v (NH3)=0.5molL﹣1s﹣1
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若降低温度,反应速率将会减小且平衡将被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.制陶的主要原料是石英砂
B.制作陶器一般分为制泥、成型、干燥、烧成等步骤
C.制陶过程中温度越高越好,这样制得的陶器牢固
D.在氧化气氛中烧制得灰陶,在还原气氛中得红陶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是
A. 用0.1026mol/L的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为22.35mL
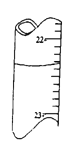
B. 用标准烧碱溶液滴定待测的醋酸溶液,应以酚酞为指示剂
C. 若200mLc(H+)=1×10-3mol/L的某一元酸和100mLc(OH-)=1×10-3mol/L的某一元碱相混合后,溶液呈碱性。则所用的酸和碱可能是等浓度的弱酸和强碱
D. 25℃时,若pH=a的10体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则a+b=15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,平衡常数如下:
2NO2![]() N2O4 K1 NO2
N2O4 K1 NO2![]() 1/2N2O4K2 N2O4
1/2N2O4K2 N2O4![]() 2NO2 K3
2NO2 K3
推导K1与K2,K1与K3的关系分别为:______________。
(2)衡量催化剂的性能指标有:活性、选择性、稳定性、价格等。对于给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的____(填“产率”、“比率”、转化率),催化剂的这种特性,称作它的________性。
(3)溶液的pH对Cr2O72-降解率的影响如下图所示。
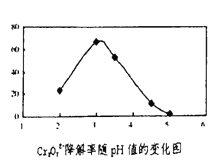
已知:Cu2O![]() Cu+CuSO4;
Cu+CuSO4;
酸性越大,Cr2O72-被还原率越大。
①由上右图可知,pH分别为2、3、4 时,Cr2O72-的降解率最好的是______,其原因是______。
②按右图加入10滴浓硫酸,溶液由橙黄色变为橙色,请结合化学用语用平衡移动原理解释其原因_____。
(4)一定条件下焦炭可以还原NO2,反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。在恒温的密闭容器下,6molNO2和足量C 发生该反应,测得平衡时NO2的物质的量与平衡总压的关系如图所示:
N2(g)+2CO2(g)。在恒温的密闭容器下,6molNO2和足量C 发生该反应,测得平衡时NO2的物质的量与平衡总压的关系如图所示:
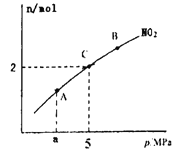
则C点NO2的转化率和C点时该反应的压强平衡常数Kp=(K,是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)分别为______、_______。
(5)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正c(CO)·c(O2),逆反应速率为v逆=K逆c(CO2)·c(O),K正、K逆为速率常数。在2500K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_______(保留小数点后一位小数)。
CO2+O。其正反应速率为v正=K正c(CO)·c(O2),逆反应速率为v逆=K逆c(CO2)·c(O),K正、K逆为速率常数。在2500K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_______(保留小数点后一位小数)。
(6)利用水煤气合成二甲醚的三步反应如下:
①2H2(g) + CO(g) ![]() CH3OH(g); ΔH1
CH3OH(g); ΔH1
②CH3OH(g) ![]() CH2OCH3(g) + H2O(g); ΔH2
CH2OCH3(g) + H2O(g); ΔH2
③CO(g) + H2O(g) ![]() CO2(g) + H2(g); ΔH3
CO2(g) + H2(g); ΔH3
总反应: 3H2(g)+3CO(g) ![]() CH2OCH3(g)+CO2(g)的ΔH=_______。
CH2OCH3(g)+CO2(g)的ΔH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 用过滤法除去食盐水中的少量泥沙
B. 用水溶解可除去氢氧化钠中的碳酸钠
C. 用蒸发结晶的方法从食盐水中提取氯化钠
D. 用加热法除去水中溶解的少量氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.1mol/L盐酸与50mL 0.2mol/L 氨水混合,在所得溶液中( )
A. c(Cl-)>c(NH4+)> c(OH-)> c(H+) B. c(Cl-)=c(NH4+)> c(OH-)= c(H+)
C. c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3.H2O) D. c(H+)+ c(NH4+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 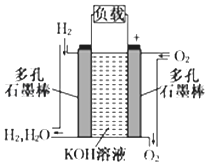
(1)通入氢气的一极为极.
(2)写出氢氧燃料电池工作时正极电极反应方程式: .
(3)该氢氧燃料电池每转移0.3mol电子,消耗标准状态下L氧气.
(4)若将此燃料电池改进为直接以甲醇(CH3OH)和氧气为原料进行工作时,负极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com