
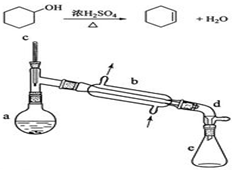
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.分析 (1)根据装置图可知装置b的名称;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;
(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
(5)无水氯化钙用于吸收产物中少量的水;
(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管;
(7)环己醇为0.2mol,根据反应方程式,理论上可以得到0.2mol环己烯,其质量为16.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)依据装置图分析可知装置b是蒸馏装置中的冷凝器装置,
故答案为:直形冷凝器;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,故选B,
故答案为:防止暴沸;B;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚为 ,
,
故答案为: ;
;
(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出,
故答案为:检查是否漏液;上口倒出;
(5)分离提纯过程中加入无水氯化钙的目的是利用无水氯化钙吸收产物中少量的水,
故答案为:干燥;
(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管,
故选:CD;
(7)环己醇为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,所以产率=$\frac{10g}{16.4g}$×100%=61%,
故选C.
点评 本题考查了物质制备实验方案设计,醇性质的分析应用,实验现象和原理的分析判断,掌握基础是解题关键,题目难度中等.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
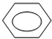 +HO-NO2→
+HO-NO2→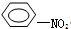 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方法 | 实验现象及结论 |
| 取少量待测物于试管中,加水溶解后,滴加少量稀硫酸 | 出现无色气体溢出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).
ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).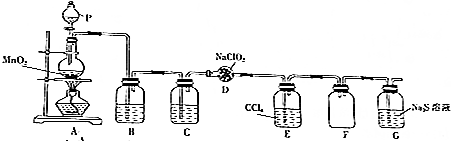
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com