
[化学——选修2:化学与技术]
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途。回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为_________________;该反应在___________________(填设备名称)中进行。
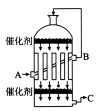
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的______(填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有_______(填设备名称)中用______吸收,得到浓硫酸或发烟硫酸。
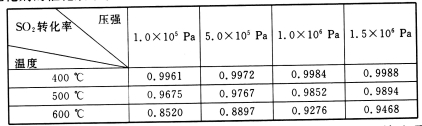
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如下表所示。已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是___________。
(4)欲提高SO2的反应速率和转化率,下列措施可行的是__________(填选项字母)。
A.向装置中通入氮气且保持体积不变 B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂 D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500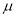 L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源:2015-2016学年江西吉安一中高二下第二次段考化学试卷(解析版) 题型:推断题
药物菲那西汀的一种合成路线如下:
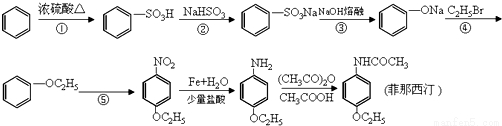
(1)菲那西汀的分子式_______________;
(2)反应②中生成的无机物的化学式为_______________;
(3)写出⑤反应的化学方程式_______________;
(4)菲那西汀水解的化学方程式是_______________;
(5)菲那西汀的同分异构体中,符合下列条件的共有_______种。
①含苯环且只有对位两个取代基 ②苯环上含有氨基 ③能水解,水解产物能发生银镜反应.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.3d3表示3d轨道上有3个电子
C.1s电子云呈球形,表示电子绕原子核做圆周运动
D.电子云图的黑点密度越大,说明核外空间电子数越多
B.ns能级的原子轨道图可表示为右图
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:填空题
近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx,挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g) 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)  CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;
CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;
(2)在3.0 L密闭容器中,通入0.10 mol CH4和0.20 mol NO2,在一定温度进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据计算0~4min内v(NO2)=_________,该温度下的平衡常数K=________。
(3)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):
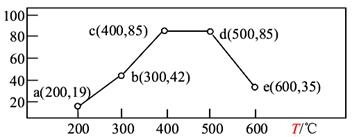
则下列叙述正确的是____________。
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数:c点=d点
D.提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
(4)用0.05 mol·L-1Na2S溶液吸收上述甲烷中含有的H2S气体,当吸收的H2S的物质的量与原Na2S的物质的量相等时溶液显碱性,此时溶液中有关粒子的表达式正确的是( )
A.n(Na+)=0.1 mol B.c(Na+)-c(OH-)>c(S2-)+c(HS-)-c(H+)
C.c(H2S)+c(H+)<c(S2-)+c(OH-) D.c(Na+)-c(H2S)=2c(S2-)+c(HS-)
测得25℃时溶液中的c(H2S)=1.0×10-4mol·L-1,则溶液的pH=________。
(5)将(1)中CH4+2NO2 CO2+2H2O+N2的反应设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-;则电池的正极电极反应式为______________。
CO2+2H2O+N2的反应设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-;则电池的正极电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
分析下列实验操作,其中可能不能达到实验目的的是( )
序号 | 实验操作 | 实验目的 |
① | 将足量的SO2气体通入装有品红溶液的试管中 | 研究SO2具有漂白性 |
② | 向盛有1mL AgNO3溶液的试管中滴加几滴NaCl溶液,再向其中滴加几滴Na2S溶液 | 比较Ksp(AgCl)与Ksp(Ag2S)的大小 |
③ | 测定等物质的量浓度的HCl、HNO3的pH | 比较Cl、N的非金属性强弱 |
④ | 向2支试管中加入同体积同浓度H2C2O4溶液,再分别加入同体积不同浓度的酸性KMnO4溶液 | 研究浓度对反应速率的影响 |
A.②③④ B.①③④ C.①②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三模拟押题理综化学试卷(解析版) 题型:选择题
下列有机物的同分异构体数目(不考虑立体异构)由小到大的顺序是
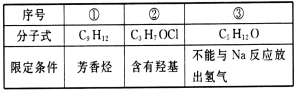
A.③②① B.②③① C.③①② D.②①③
查看答案和解析>>
科目:高中化学 来源:2016届福建师大附中高三下学期模拟考试理综化学试卷(解析版) 题型:简答题
【化学——选修3:物质结构与性质】
物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol(C2H5O)3P=O分子中含有的σ键的数目为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:
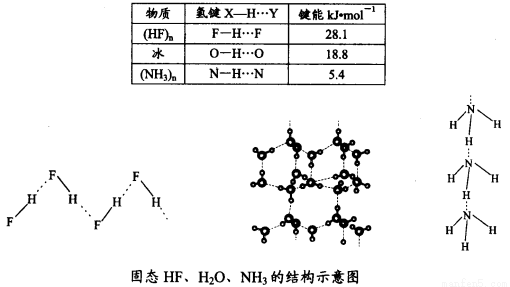
解释H2O、HF、NH3沸点依次降低的原因___________________。
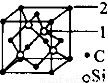
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为________pm,碳化硅的密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一平行班下期中化学试卷(解析版) 题型:选择题
实现下列变化时,需要克服相同类型作用力的是( )
A.水晶和干冰的熔化 B.食盐和醋酸钠的熔化
C.乙醇和HCl溶于水 D.HCl和NaCl溶于水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g) 2HBr(g)△H<0. 当温度分别为T1、T2,平衡时, H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
2HBr(g)△H<0. 当温度分别为T1、T2,平衡时, H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
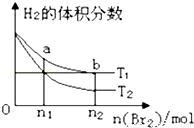
A.由图可知:T2>T1
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取增加Br2 (g)通入量的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com