
【题目】某固定体积的密闭容器中,加入—定量的A达化学平衡: aA(g)![]() B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
A. 若a=b+c时,B的物质的量分数变大 B. 若a=b+c时,B的物质的量分数不变
C. 若a>b+c时,A的转化率不变 D. 若a<b+c时,A的转化率变大
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列物质的属类归纳不正确的是( )
A. 由两种或两种以上元素组成的纯净物称为化合物
B. 由一种元素组成的纯净物是单质
C. 由一种物质组成的称为纯净物
D. 含氧元素的化合物称为氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( )

A. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 温度T下,该反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有色金属研究室对从银锰精矿中提取单质银的方法进行改良创新,从而更高效地实现锰和银的分离。其简易流程如下图。已知:银锰精矿主要成分为MnO2和银单质。
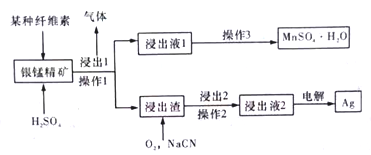

(1)操作1与操作2所对应的分离方法是__________________。
(2)通过对“浸出1”步骤中纤维细度的控制,绘制出一定时间内纤维素-Mn浸出率图象如上图所示,实际生产中应控制细度________mm较为合适,理由是_________。
(3)在“浸出1”步骤中,纤维素会先水解为单糖,请写出该单糖(用分子式表达)与银锰精矿反应的离子方程式:_______________________。
(4)浸出液2的主要成分为[Ag(CN)2]-,使用情性电极电解浸出液2,请写出阴极的电极方程式:________。本流程中可循环使用的物质为_________________。
(5)通过上述流程,浸出液1中通常还含有少量银离子,充分提取银,可对MnSO4·H2O晶体进行洗涤,请简述洗涤的方法_____________________________。将洗涤液与母液合并,加入盐酸,过滤后再经过以下步骤可回收大部分浸出液1中的银。试剂a是______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/cm3。
(1)此浓盐酸的物质的量浓度是多少?(列式计算)_________________
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?(列式计算)_____________
(3)用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号)_________________
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.氨水应密闭保存于低温处
C.打开汽水瓶时,有大量气泡逸出
D.高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN废液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是_____________。
②浓度均为0.5 mol/L的NaCN和HCN的混合溶液显_________(填“酸”“碱”或“中”)性,通过计算说明:___________________________________。
(2)滤渣1的主要成分是______________(填化学式)。
(3)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_____________。
(4)系列操作B为_________________。
(5)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:_______________。
(6)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移向催化剂____________(填“a”或“b”)。
②催化剂a表面发生的反应为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碘水中的碘萃取出来的实验中,下列说法不正确的是
A. 分液漏斗使用前要检验它是否漏水
B. 萃取剂要求不溶于水,且比水更容易使碘溶解
C. 用CCl4作萃取剂,萃取后液体分层且下层无色
D. 分液时,打开旋塞,使下层液体流出,上层液体从上口倒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com