
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键有方向性和饱和性,属于共价键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 范德华力是一种分子间作用力,也是一种特殊的化学键 | |
| D. | 常温常压下,卤素单质从F2→I2由气态、液态到固态的原因是范德华力逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题





查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 碳棒上有气体放出,溶液酸性变弱 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电流从a极到b极 | |
| D. | a极上发生了还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
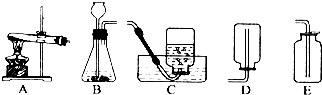
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
| 苯胺 | 对氨基苯磺酸 | |
| 熔点 | -6.3℃ | 288℃ |
| 沸点 | 184℃ | (300℃开始分解炭化) |
| 水溶性 | 微溶于水 | 微溶于冷水、溶于热水 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com