

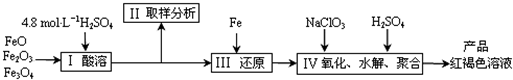
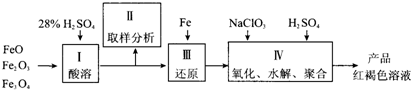
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比
(b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量
(d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + 2NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42ˉ与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42ˉ与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
答案:
(1)b
(2)b、c
(3)利:原料成本较低 弊:产生气体对大气有污染
(4)a、c
(5)Fe2O3、BaSO4
(6)b、e、d
解析:本题综合考查铁及其化合物的性质,一定质量分数溶液的配制及化学实验基本操作等内容。(1)根据配制一定质量分数溶液的配制步骤,可知所需玻璃仪器除量筒外,还需要烧杯。(2)铁的氧化物溶于H2SO4时可得含Fe2+、Fe3+的溶液,而为抑制Fe3+水解,原料中Fe3+必须还原为Fe2+,为确定下一步铁的用量必须测定Fe3+含量,而再用NaClO3将Fe2+氧化为Fe3+时,NaClO3的用量取决于Fe2+的总量,故选b、c。(3)由所给反应知氧化6 mol FeSO4需HNO3 2 mol价格为0.32 元,需NaClO3 1 mol价格为0.45 元,故用HNO3代替NaClO3的利在于原料成本降低,而弊则是产生的NO会污染环境。(4)~(6)要测定SO![]() 与Fe3+的物质的量之比,只需分别测定一定量的溶液中SO
与Fe3+的物质的量之比,只需分别测定一定量的溶液中SO![]() 的物质的量和Fe3+的物质的量即可,故所选用的试剂为BaCl2和NaOH,通过过滤、洗涤、烘干灼烧,冷却称量可得m(BaSO4)和m(Fe2O3),进而计算得出答案。
的物质的量和Fe3+的物质的量即可,故所选用的试剂为BaCl2和NaOH,通过过滤、洗涤、烘干灼烧,冷却称量可得m(BaSO4)和m(Fe2O3),进而计算得出答案。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)铁及铁的化合物在生产、生活中有着重要的用途。
(1)聚合硫酸铁(简称PFS)的化学式为 [ Fe (OH)n(S04)(3-n) / 2 ]m ,现代潜水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用做显影剂,该化合物中存在的化学键类型有_____ ____。
(3)CN一中碳原子的杂化轨道类型是 _______ :写出一种与CN一互为等电子体的分子的化学式_____ ___;
(4)三氯化铁常温下为固体,熔点304℃,沸点3160C 在3000C以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为______ 晶体。
(5)普鲁士蓝是一种配合物,可用作染料,它的结构单元如下图所示,普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)= _____ ___。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省师大附中高二下学期期中考试化学试卷 题型:填空题
(10分)铁及铁的化合物在生产、生活中有着重 要的用途。
要的用途。
(1)聚合硫酸铁(简称PFS)的化学式为 [ Fe (OH)n(S04) (3-n) / 2 ]m ,现代潜水处理工艺中常利用PFS在水体中形成絮状物 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用做显影剂,该化合物中存在的化学键类型有_____  ____ 。
____ 。
(3)CN一中碳原子的杂化轨道类型是 _______ :写出一种与CN一互为等电子体的分子的化学式_____ ___;
(4)三氯化铁常温下为固体,熔点304℃,沸点3160C 在3000C以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为______ 晶体。
(5)普鲁士蓝是一种配合物,可用作染料,它的结构单元如下图所示,普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)= _____ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com