
下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
C
【解析】
试题分析:A硅酸钠是强碱弱酸盐,在溶液中水解是溶液显碱性,所以向硅酸钠溶液中滴加1滴酚酞溶液变为红色,然后逐滴加入稀盐酸,由于硅酸钠不断发生反应产生NaCl,溶液的碱性逐渐减弱,所以红色逐渐褪去,可以证明酸性盐酸>硅酸,正确;B.在在酒精灯上加热铝箔,金属与O2在加热时发生反应产生Al2O3,由于Al2O3的熔点是2050℃,高于Al的熔点660℃,所以铝箔熔化但不滴落,正确;C.在常温下,向浓硫酸中投入铁片,由于浓硫酸有强氧化性,会把Fe氧化产生一层致密的氧化物保护膜而阻止了金属的进一步反应,即发生钝化现象,因此铁片不溶解,不明说常温下,铁不与浓硫酸反应,错误;D.向某溶液中先滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变成血红色,是因为发生反应:2Fe2++Cl2=2Fe3++2Cl-, Fe3+与SCN-发生络合反应形成络离子,是溶液显红色,可以证明溶液中含有Fe2+,没有Fe3+,正确。
考点:考查实验操作和现象与结论关系的正误判断的知识。


科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
下列叙述中,不能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(7分)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)==2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为 296kJ·mol
296kJ·mol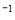 。
。
在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为___________________________。
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:
HNCO+NO2→N2+CO2+ (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列关于元素周期表和元素周期律的说法正确的是
A.ⅥA族元素的原子半径越大,越容易得到电子
B.I A族与VIIA族元素间能形成离子化合物也能形成共价化合物
C.I A族元素的金属性比ⅡA族元素的金属性强
D.原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)采用32%~35%的FeCl3溶液腐蚀印刷线路板上的金属铜,腐蚀废液中主要含有CuCl2、FeCl2和HCl等溶质。
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为 。
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、洗涤、 。
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000 g分别放入甲、乙、丙三个烧杯中,再加入100 mL 0.5 mol·L-1的硫酸,水浴加热(70 ℃),搅拌,进行除铁处理。分别在第10、20、30、40、50 min时,用吸管移取0.5 g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如下图所示。
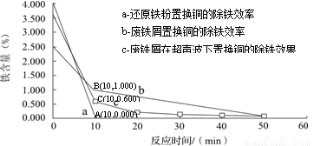
你认为除铁效果最好的是 (填“a”、“b”或“c”),其原因是 。
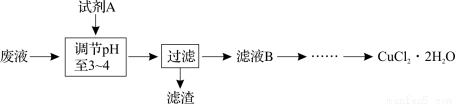
(3)工业上可用腐蚀废液制备CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀 | 2.3 | 7.5 | 4.7 |
完全沉淀 | 4.1 | 9.7 | 6.7 |
试剂A最好应选用 (填写字母代号),理由是 。
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.常温下,23 g NO2含有氧原子的数目为NA
B.1.00 mol·L-1 NaCl溶液中含有Na+的数目为NA
C.标准状况下,39 g苯中含有的碳碳双键数为1.5NA
D.常温常压下,22.4 L乙烯中含C-H键的数目为4NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:填空题
(12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)过滤操作用到的玻璃仪器有: 。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(4)写出KMnO4溶液加入到MnSO4溶液中制备MnO2的离子反应方程式: ;用惰性电极电解MnSO4溶液也可制得MnO2,其阳极的电极反应式是 。
(5)MnO2是碱性锌锰电池的电极材料,电池反应方程式为:2MnO2+Zn+H2O====2MnOOH+Zn(OH)2,写出该电池放电时,正极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:选择题
下列有关物质性质、应用的说法正确的是
A.氯化铝是电解质,可电解其水溶液获得金属铝
B.二氧化硅具有导电性,可用于生产光导纤维
C.SO2具有漂白性,可用于将银耳漂白为“雪耳”
D.小苏打可与酸反应,可用作治疗胃酸过多的药剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:选择题
用下列实验装置和方法进行相应实验,能达到实验目的的是
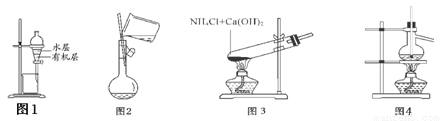
A.图1所示装置:用苯萃取溴水中的Br2
B.图2所示的装置:向容量瓶中转移液体
C.图3所示的装置:制备少量氨气
D.图4所示的装置:制蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com