
����Ŀ��������25�桢101kPaʱ����1Lˮ�п��ܽ�0.09mol��ʵ��������ˮ��Cl2Լ��![]() ��ˮ��Ӧ����ش��������⣺
��ˮ��Ӧ����ش��������⣺
��1���÷�Ӧ�����ӷ���ʽΪ________��
��2����÷�Ӧ��ƽ�ⳣ��Ϊ________���������ӷ���ʽ���㣩��
��3��������ƽ����ϵ�м�������KOH���壬ƽ�⽫________���������Ӧ���������淴Ӧ���������ƶ���
��4���������������ѹǿ��������ˮ�е��ܽ�Ƚ�________�����������С�����䡱����ƽ�⽫________���������Ӧ���������淴Ӧ���������ƶ���
���𰸡� Cl2+H2O![]() H++Cl��+HClO 4.5��10��4 ����Ӧ���� ���� ����Ӧ����
H++Cl��+HClO 4.5��10��4 ����Ӧ���� ���� ����Ӧ����
��������
��1��������ˮ��Ӧ��������ʹ����ᣬ��������������ʣ�
��2����1Lˮ�п��ܽ�0.09mol��������������Ũ��Ϊ0.09mol/L�����ƽ�����ƽ��״̬����Ũ�ȣ�����ƽ�ⳣ���������õ���
��3�������������ƣ���Һ�е����������Ӻ������ӷ�Ӧ��ƽ��������У�
��4�������ܽ����ѹǿ���������ƽ�������������С�ķ�����С�
��1��������ˮ��Ӧ��������ʹ����ᣬ��Ӧ�����ӷ���ʽΪCl2+H2O![]() H++Cl��+HClO��
H++Cl��+HClO��
��2����1Lˮ�п��ܽ�0.09mol��������������Ũ��Ϊ0.09mol/L������ƽ������ʽ��ʽ����õ�ƽ��Ũ�ȣ�
Cl2+H2O![]() H++Cl��+HClO
H++Cl��+HClO
��ʼŨ�ȣ�mol/L�� 0.09 0 0 0
ת��Ũ�ȣ�mol/L�� 0.03 0.03 0.03 0.03
ƽ��Ũ�ȣ�mol/L�� 0.06 0.03 0.03 0.03
K=![]() =4.5��10��4��
=4.5��10��4��
��3��������ƽ����ϵ�м�������NaOH���壬���ƽ��״̬�µ������ӷ�Ӧ��������Ũ�ȼ�С��ƽ��������У�
��4��������ƽ���м�ѹ��ƽ�������������С�ķ�Ӧ������У�ƽ��������Ӧ�����ƶ����������ܽ��������ӡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W���ֶ�����Ԫ�ص�ԭ��������������,����X��Y��Z��W���γɵij��������10e��18e���ڳ����¾�Ϊ��̬����Ԫ�����ڱ���Z��W����,Y������������ˮ���������⻯�ﷴӦ������,��Y�ĺ˵������W����ɲ��������ͬ��
��1��Z���ӵĽṹʾ��ͼ��_____________________________��
��2��X��Y��W�����һ�ֻ����ԭ�Ӹ�����Ϊ4��1��1���û�����Ļ�ѧʽ��_______�����к��еĻ�ѧ����__________________��
��3��X��Y���γɵķ��ӵĵ���ʽΪ__________������ͬ��������Ԫ�ص��⻯��е�ߵ�ԭ����__________________��
��4�����Z��W�Ľṹ��˵��Z��W����Ԫ�طǽ����Ե�ǿ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ�������� Ca��OH��2��Һ��ͨ�������̼������� CaCO3 ��ɫ�����������������̼���֮��Ĺ�ϵ���ߣ�
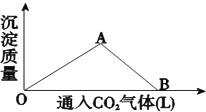
�Իش�
OA ������ʾ�ķ�Ӧ���ӷ���ʽ�ǣ�________��AB ������ʾ�ķ�Ӧ��ѧ����ʽ�ǣ�________���� B �����ɵ���Һ��У��ɼ�����������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ������ĺ���������XΪ��Ҫԭ�������ɽ�������PCL{![]() }����ȼ������˫��A���ϳ���·���£�
}����ȼ������˫��A���ϳ���·���£�
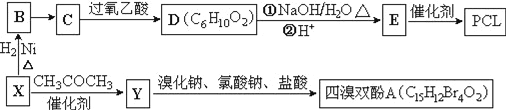
��֪����X�������ܶ�����ͬ������H2��47������FeCl3��Һ����ɫ��CΪ![]() ��
��
��![]() ��
��
��RCOCH2R��![]() RCOOCH2R�䡣
RCOOCH2R�䡣
��1��B��������_________________��
��2��B��C����Ҫ�ķ�Ӧ�Լ���������___________��C��D�ķ�Ӧ������______________________��
��3��д��X��Y�Ļ�ѧ����ʽ��_______________________________��
��4��0.5mol����˫��A��һ����������������NaOH��Һ��Ӧ���������__molNaOH��
��5����������������D��ͬ���칹����__�֣������ǿռ��칹����
�ٺ��������������ֹ����� ����ʹ���CCl4��Һ��ɫ ���ܷ���������Ӧ
��6����֪��ϩ��ֱ���Ʊ������������·���Ϊ��
![]()
������ϩΪ�л�ԭ�ϣ�����ͷ�Ӧ������ѡ���ϳɾۺ���Ϳ��![]() ��д���ϳɸ�Ϳ�ϵķ�Ӧ����ͼ��________________________________��
��д���ϳɸ�Ϳ�ϵķ�Ӧ����ͼ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3AsO3)����Ԫ���ᣬ�����������ư�Ѫ����H3AsO3ˮ��Һ�к������ֵķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������pH�Ĺ�ϵ����ͼ������˵����ȷ����
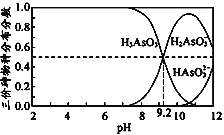
A. H3AsO3�ĵ��뷽��ʽΪ��H3AsO3![]() 3H++ AsO33
3H++ AsO33
B. H3AsO3��һ���ĵ��볣��ΪKa1����Ka1��10��9.2
C. H3AsO3��Һ��pHԼΪ9.2
D. pH��12ʱ����Һ��c(H2AsO3��) + 2c(HAsO32��) + 3c(AsO33��) + c(OH��)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��1��CH3COOH(l)+2O2(g) == 2CO2(g)��2H2O(l) ��H1����870.3 kJ��mol-1
��2��C(s)+ O2(g) == CO2(g) ��H2����393.5 kJmol-1
��3��H2(g) +![]() O2(g) == H2O(l) ��H3����285.8kJ��mol-1
O2(g) == H2O(l) ��H3����285.8kJ��mol-1
��Ӧ2C(s)+2H2(g) +O2(g) == CH3COOH(l)����HΪ�� ��
A. ��488.3 kJ��mol-1 B. ��244.15 kJ��mol-1 C. +488.3 kJ��mol-1 D. +244.15 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ���ҵ�����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2) �ڴ����������ºϳɼ״�������������Ӧ����:
��CO(g)+2H2(g) ![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=-58kJ/mol
CH3OH(g)+H2O(g) ��H=-58kJ/mol
��CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H=+41kJ/mol
CO(g)+H2O(g) ��H=+41kJ/mol
�ش���������:
(1)��֪��Ӧ���е���صĻ�ѧ��������������:
��ѧ�� | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | a | b | c | d | x |
��x=______�����ú�������ĸ�Ĵ���ʽ��ʾ��
(2)����lmolCO2��2molH2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�ڡ����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ��
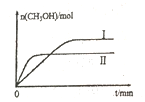
�����ߢ��Ӧ��ƽ�ⳣ����С��ϵΪK��_____K��(�>��=����<��)
��һ���¶���,���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����______��
a.������ѹǿ����
b.�״���ˮ����������ȱ��ֲ���
c.v��(H2)=3v��(CH3OH)
d.2��C=O���ѵ�ͬʱ��3��H-H�γ�
����5min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ_____�����¶��µ�ƽ�ⳣ��Ϊ_____���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���____��
a.�����¶� b.ʹ�ú��ʵĴ��� c.����He d.��ԭ�����ٳ���CO2��H2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com