
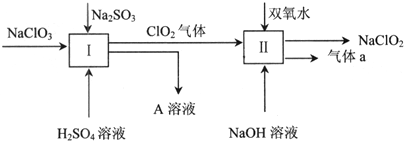
分析 由制备流程可知,硫酸钠溶液通I中,NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O;然后ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,以此来解答.
解答 解:由制备流程可知,硫酸钠溶液通I中,NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O;然后ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,
(1)I中发生2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O,S元素的化合价升高,则还原剂为Na2SO3,故答案为:Na2SO3;
(2)由I中反应可知,反应后为硫酸钠溶液,溶质为Na2SO4,故答案为:Na2SO4;
(3)Cl元素的化合价降低,O元素的化合价应升高,该反应生成氧气,且反应在碱性溶液中进行,则由电子、电荷守恒可知,离子反应为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,故答案为:2OH-;O2↑.
点评 本题考查制备实验,为高频考点,把握物质的性质、制备流程中的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 7.8g 苯中含有的单键数目为0.9NA | |
| B. | 1 mol Cl2溶于水,与水反应时电子转移数目为1 NA | |
| C. | 在298K 1.01×105pa下,22 g CO2和N2O混合气体中,所占的体积大于11.2升 | |
| D. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | 除④外 | C. | 除③④外 | D. | 除②⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | l mol金刚石中,含2 mol C-C键 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,CO2的结构式为O=C=O.
,CO2的结构式为O=C=O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com