
| A. | 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/L),所得溶液的密度为ρg/mL,所配溶液的物质的量浓度c=$\frac{1000Vρ}{(17V+22400)}$ | |
| B. | 只含0.1mol、NH4+、0.1molCa2+、0.1molCO32-和0.1molCl-的溶液 | |
| C. | 质量分数为a%,物质的量浓度为c1mol/L的稀硫酸蒸发水后,其质量分数为2a%,物质的量浓度为c2mol/L,则2c1>c2 | |
| D. | 仅用1 000 mL的容量瓶、烧杯、玻璃棒、量筒、58.5 g NaCl固体和水配制1 L 1 mol/L的NaCl溶液 |
分析 A.根据n=$\frac{V}{{V}_{m}}$计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液的体积,根据c=$\frac{n}{V}$计算溶液物质的量浓度;
B.钙离子与碳酸根离子反应生成碳酸钙沉淀;
C.利用c=$\frac{1000ρω}{M}$计算硫酸的物质的量浓度,且硫酸溶液的浓度越大其密度也越大,以此来解答;
D.配制一定物质的量浓度的溶液时需要使用胶头滴管.
解答 解:A.标准状况下VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,氨气的质量为:$\frac{V}{22.4}$mol×17g/mol=$\frac{17V}{22.4}$g,该溶液的质量为:1000g+$\frac{17V}{22.4}$g,则所得溶液体积为:$\frac{\frac{17V}{22.4}g+1000g}{1000ρg/L}$=$\frac{17V+22400}{22400ρ}$L,氨气的物质的量浓度c=$\frac{\frac{V}{22.4}mol}{\frac{17V+22400}{22400ρ}L}$=$\frac{1000ρV}{17V+22400}$mol/L,故A正确;
B.Ca2+、CO32之间反应生成难溶物碳酸钙,不能共存于同一溶液,故B错误;
C.设将溶质质量分数为a%的硫酸溶液密度为ρ1,则c1=$\frac{1000{ρ}_{1}a%}{98}$mol/L=$\frac{10a{ρ}_{1}}{98}$mol/L,设将溶质质量分数为2a%的硫酸溶液密度为ρ2,则c2=$\frac{1000{ρ}_{2}2a%}{98}$mol/L=$\frac{20a{ρ}_{2}}{98}$mol/L,所以c1:c2=$\frac{10a{ρ}_{1}}{98}$mol/L:$\frac{20a{ρ}_{2}}{98}$mol/L=ρ1:2ρ2,即c2=$\frac{2{ρ}_{2}}{{ρ}_{1}}$c1,硫酸溶液的浓度越大密度也越大,所以ρ2>ρ1,所以$\frac{2{ρ}_{2}}{{ρ}_{1}}$c1>2,即2c1<c2,故C错误;
D.配制1 L 1mol/L的NaCl溶液时必须使用胶头滴管定容,所以还缺少胶头滴管,无法完成该实验,故D错误;
故选A.
点评 本题考查了物质的量浓度的计算与判断、离子共存的判断等知识,题目难度中等,明确物质的量浓度的计算方法为解答关键,注意掌握配制一定物质的量浓度的方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Mg2+的电子排布图: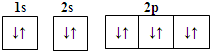 | B. | Na+的结构示意图: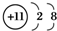 | ||
| C. | Cr的价层电子排布式:3d54s1 | D. | C的电子排布式:1s22s12p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=13的溶液:SO32-、Na+、Al3+ | |
| B. | 使甲基橙溶液变红色的溶液:Na+、SO42-、CO32- | |
| C. | 在c(H+)=10-12mol/L的溶液:NH4+、Cl-、NO3- | |
| D. | 加入足量Na2O2后的溶液:K+、Cl-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数目为0.5NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 常温常压下,22.4L H2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
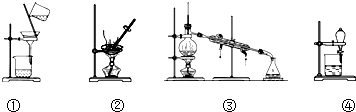
| A. | 除去KCl溶液中的K2CO3,加入适量Ca(NO3)2溶液,再用①装置分离 | |
| B. | 用②装置除去自来水中的Cl-等杂质 | |
| C. | 回收碘的CCl4溶液中的CCl4,可选用③装置 | |
| D. | 分离水和植物油,选用④装置,下层的植物油可从分液漏斗的下层放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ③ | C. | ④ | D. | 以上都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com