
| A. | 分别加入碘水,观察颜色反应 | B. | 分别加热,观察是否生成沉淀 | ||
| C. | 加入淀粉酶观察是否水解 | D. | 分别加入KI溶液,观察颜色反应 |
科目:高中化学 来源: 题型:选择题
| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4中含有的C原子数目为NA | |
| D. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,所含Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:CO32-、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:NH4+、K+、CH3COO-、Cl- | |
| C. | pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- | |
| D. | 水电离的c(H+)=10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的摩尔质量为16 | |
| B. | 1molH2O的质量为18g/mol | |
| C. | H2的气体摩尔体积约为22.4L | |
| D. | 在标准状况下,22.4 L由N2、N2O组成的混合气体的物质的量约1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ①④⑤ | C. | ①④⑦ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
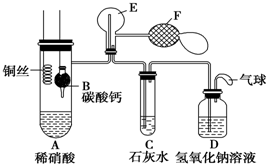 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2HPO4+NaH2PO4 | B. | Na3PO4 | C. | NaH2PO4 | D. | Na3PO4+NaH2PO4 | ||||
| E. | Na3PO4+Na2HPO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com