
在下列①~⑩中选出适宜的词语填入下列每小题的空格中(填编号):
①渗析 ②盐析 ③聚沉 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳
⑧丁达尔现象 ⑨中和 ⑩水解
(1)肥皂水中透过强光,可以见到光亮的“通路”。这种现象称为___________。
(2)在制取肥皂时,加入食盐细粒使肥皂析出,这个过程称为_____________。
(3)在肥皂水中滴加酚酞,溶液变成红色,说明高级脂肪酸根离子发生了____________。
(4)在氢氧化铁胶体中加入浓硫酸铵溶液,产生红褐色沉淀,这种现象叫做___________。
(5)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做___________。
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为________mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为______________________________,产品2的化学式为__________,1 L浓海水最多可得到产品2的质量为________g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为________________________;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是
A 生成物能量一定低于反应物总能量
B 放热反应的反应速率总是大于吸热反应的反应速率
C 英语盖斯定律,可计算某些难以直接侧脸房的反应焓变
D 同温同压下, 在光照和点燃条件的
在光照和点燃条件的 不同
不同
查看答案和解析>>
科目:高中化学 来源: 题型:
存放下列试剂的方法中,有错误并且会引起危险的是 ( )
A.白磷浸在盛有CS2的敞口试剂瓶中 B.金属钠浸在盛有煤油的试剂瓶中
C.浓硝酸存放在棕色试剂瓶中 D.溴水放在带橡皮塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑2NO2 N2O4)。
N2O4)。
(1)硝酸在该反应中的作用是__________________。(1分)
(2)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________;所得溶液(假设溶质不扩散)的物质的量浓度是___________ 。
(3)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式_________________________________________________________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组,其原因是_ ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
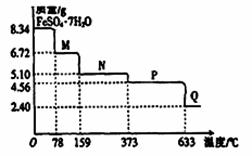
8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
A.温度为78℃时固体物质M的化学式为FeSO4?5H2O
B.温度为l59℃时固体物质N的化学式为FeSO4?3H2O
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4  FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.含有NA个氦原子的氦气在标准状况下的体积约为22.4 L
B.25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
C.在常温常压下,11.2 L Cl2含有的分子数为0.5 NA
D.标准状况下,11.2 L H2O含有的分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加 热到1500 ℃生成白磷,反应为:
热到1500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10
10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸 钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I-
2S2O +I2===S4O
+I2===S4O +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol·L-1I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO +5SO
+5SO +2H+===I2+5SO
+2H+===I2+5SO +H2O
+H2O
生成 的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01 mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol·L-1Na2SO3溶液的体积/mL | H2O的 体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
该实验的目的是________________________________________________________________________;
表中V2=________mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的 蕴藏量居世界首位。
蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是__________________________________________
_________________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3。Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O===Ce(OH)4↓+______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com