


科目:高中化学 来源: 题型:阅读理解
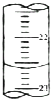 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第9期 总第165期 人教课标版(选修4) 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液。发生的反应为:
5H2C2O4+2KMnO4+3H2SO4 = 5CO2↑+2MnSO4+K2SO4+8H2O
(1)KMnO4溶液应盛在_________(填“酸式”或“碱式”)滴定管中。
(2)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20 mL,则滴定管中液体的体积为______(填代号)。
A.5.20 mL B.19.80 mL C.大于19.80 mL D.小于19.80 mL
(3)本实验是否需要外加指示剂? (填“是”或者“否”)。到达滴定终点时,溶液的颜色由 色变为 色。
(4)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(5)该牛奶中钙的含量为_________mg/100mL。
(6)下列操作会使实验结果偏低的是____________(填代号)。
A.滴定管未用KMnO4溶液润洗就直接盛装KMnO4溶液
B.向锥形瓶转移沉淀时,损失部分沉淀
C.开始时平视读数,滴定完成时俯视读数
D.CaC2O4的表面没有洗涤干净,吸附少量C2O42-等杂质
查看答案和解析>>
科目:高中化学 来源:同步题 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com