
Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
A.2 B.3 C.4 D.5
科目:高中化学 来源:2017届河南省高三上学期9月月考化学试卷(解析版) 题型:选择题
下列实验能达到相应目的的是
A.用Zn与浓硫酸反应可获得高浓度SO2
B.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
C.选择相同的气体发生装置分别用Na2O2、CaCO3制备O2、CO2
D.可用分液的方法分离碘和酒精
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
在不同情况下测得A(g)+3B(g)  2C(g)+2D(g)的下列反应速率,其中反应速率最大的是( )
2C(g)+2D(g)的下列反应速率,其中反应速率最大的是( )
A.υ(D)=0.4 mol·L-1·s-1 B.υ(C)=0.5 mol·L-1·s-1
C.υ(B)=0.6 mol·L-1·s-1 D.υ(A)=0.15 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期9月月考化学试卷(解析版) 题型:填空题
镉镍可充电电池在现代生活中有着广泛的应用,它的充、放电反应如下:
Cd+2NiOOH+2H2O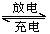 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
请回答下列问题:
(1)上述反应式中左边物质的总能量________(填“大于”“小于”或“等于”)右边物质的总能量。
(2)放电时负极发生反应的物质是________ ,
正极的电极反应式为__________________ 。
(3)镉镍废旧电池必须进行回收并集中处理,最主要的原因是____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期9月月考化学试卷(解析版) 题型:选择题
在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。下列该电池的电极反应,正确的是( )
A.负极反应为Zn-2e-===Zn2+
B.负极反应为Zn+2H2O-2e-===Zn(OH)2+2H+
C.正极反应为2MnO2+2H++2e-===2MnOOH
D.正极反应为2MnO2+2H2O+2e-===2MnOOH+2OH-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷(解析版) 题型:填空题
研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:①CaCO3 (s)=CaO(s)+CO2 (g) △H= -180 kJ·mol-l;
②2CO(g)+SO2(g)=S(s)+2CO2 (g) △H= -270 kJ·mol-l
当反应②放出135 kJ热量时,处理的SO2质量为____________;若该反应放出的热量全部用于煅烧石灰石,则处理SO2时生成CO2与煅烧石灰石时生成的CO2的质量比为___________
(2)已知:CH4(g)+4NO2( g)=4NO(g)+CO2(g)+2H2O(g) △H= -560 kJ·mol-l;
CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H=-1160 kJ·mol-1;
① 若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为_________,(用NA表示阿伏加德罗常数值),放出的热量为_________kJ。
②若1 mol CH4还原NO2时放出的热量为710 kJ,则生成的N2和NO的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-l;
C3H8 (g)+5O2( g)=3CO2(g)+4H2O(1) △H =-2220 kJ·mol-l.
现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3847 kJ,则在混合气体中H2和C3H8的体积比是( )
A.2:1 B.3:1 C.4:1 D.5:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:填空题
某温度(T℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,该温度下水的KW= 。该温度(填“大于”、“小于”或“等于”) 25℃,其理由是 。
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va:Vb= 。
(2)若所得混合溶液为中性,且a+b=12,则Va:Vb= 。
(3)若所得混合溶液的pH=10,且a=12,b=2,Va:Vb= 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北大附中河南分校高二上第一次月考化学卷(解析版) 题型:选择题
根据盖斯定律判断如下图所示的物质转变过程中,正确的是( )
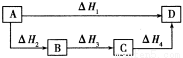
A.ΔH1=ΔH2=ΔH3=ΔH4 B.ΔH1+ΔH2=ΔH3+ΔH4
C.ΔH1+ΔH2+ΔH3=ΔH4 D.ΔH1=ΔH2+ΔH3+ΔH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com