
分析 (1)当pH相同时,说明溶液中氢离子浓度相等,如果都是一元酸,酸的电离程度越大则酸的浓度越小;如果都是强酸,一元酸浓度大于二元酸浓度;
(2)当它们物质的量浓度相同时,pH值与酸的元数及电离程度有关,酸的元数越大、酸电离程度越大,氢离子浓度越大,溶液的pH越小;
(3)加水稀释促进弱电解质电离;
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,消耗NaOH溶液体积与最终电离出氢离子物质的量成正比;
(5)三酸的pH相同时,若耗等量的Zn,则消耗最终电离出的氢离子物质的量相等,消耗的酸体积与酸最终电离出的氢离子浓度成反比.
解答 解:(1)当pH相同时,说明溶液中氢离子浓度相等,如果都是一元酸,酸的电离程度越大则酸的浓度越小,醋酸和盐酸都是一元酸且醋酸电离程度小于HCl,所以pH相同时物质的量浓度①>②;如果都是强酸,一元酸浓度大于二元酸浓度,盐酸和硫酸都是强酸,且盐酸是一元酸、硫酸是二元酸,则物质的量浓度②>③,所以pH相同时物质的量浓度最大的是①,
故答案为:①;
(2)当它们物质的量浓度相同时,pH值与酸的元数及电离程度有关,酸的元数越大、酸电离程度越大,氢离子浓度越大,溶液的pH越小,硫酸是二元强酸、HCl是一元强酸、醋酸是一元弱酸,所以物质的量浓度相同的这几种酸,pH最小的是硫酸,故答案为:③;
(3)加水稀释促进弱电解质电离,加水促进醋酸电离,HCl、硫酸完全电离,加水稀释氢离子物质的量不变,所以将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为①>②=③,
故答案为:①>②=③;
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,消耗NaOH溶液体积与最终电离出氢离子物质的量成正比,物质的量浓度和体积相同的这三种溶液,最终电离出氢离子物质的量大小顺序是2①=2②=③,这消耗NaOH体积之比为1:1:2,故答案为:1:1:2;
(5)三酸的pH相同时,若耗等量的Zn,则消耗最终电离出的氢离子物质的量相等,消耗的酸体积与酸最终电离出的氢离子浓度成反比,这三种酸最终电离出氢离子浓度为①>②=③,则消耗酸的体积为①<②=③,
故答案为:①<②=③.
点评 本题考查弱电解质的电离,侧重考查学生分析判断及计算能力,明确弱电解质电离特点及溶液pH与溶液浓度、酸的元数的关系是解本题关键,题目难度中等.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:实验题
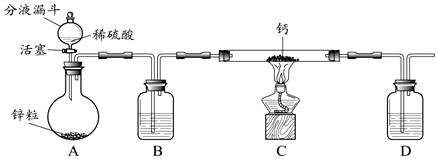
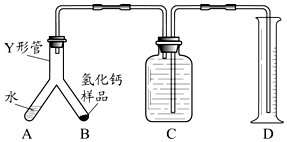
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
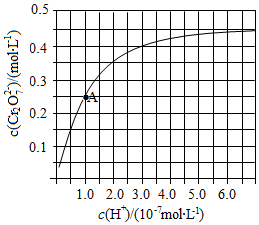 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba( NO3-)2=Ba2++( NO3-) 2 | B. | NaHSO4=Na++H++SO42- | ||
| C. | H2SO4=2H++SO42- | D. | KClO3=K++ClO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 加压可使速率加快,是因为增加活化分子百分数而使反应速率加快 | |
| C. | 活化分子的碰撞不一定都能发生化学反应 | |
| D. | 催化剂可改变反应进程,故加催化剂改变了一个反应的△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最简单氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 这个反应是氧化还原反应 | B. | 制造过程中元素种类发生改变 | ||
| C. | 另一种化合物为NaCl | D. | 金刚石属于金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
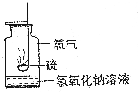 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com