
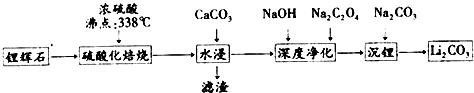
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
分析 由制备流程可知,锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去为反应的硫酸,同时调节溶液pH值,可以将Al3+转化为Al(OH)3沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出.
(1)将各元素写成氧化物,注意各元素原子数目比例不变;
(2)升高温度,反应速率加快,温度高于300℃时硫酸挥发;硫酸如果加入过多,消耗的酸多,后续中还需要除去过量的硫酸;
(3)加入碳酸钙除去未反应的硫酸,同时调节溶液pH值;
(4)“沉锂”过程是碳酸钠与Li2SO4反应生成Li2CO3;
(5)温度越高,碳酸锂溶解度降低,减少碳酸锂溶解;溶液中硫酸钠不反应,使用的碳酸钠要过量,少量碳酸锂溶解在溶液中.
解答 解:锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去为反应的硫酸,同时调节溶液pH值,可以将Al3+转化为Al(OH)3沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出.
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示,根据化合价代数和为0,可以确定Li2Al2Si4Ox中x=$\frac{1×2+3×2+4×4}{2}$=12,所以该化合物用氧化物的形式表示为Li2O•Al2O3•4SiO2,
故答案为:Li2O•Al2O3•4SiO2;
(2)温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多,反应温度控制在250-300℃,反应速率较快,避免硫酸挥发;
硫酸如果加入过多,消耗的酸多,后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担,
故答案为:温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多;ABC;
(3)加入碳酸钙除去未反应的硫酸,同时调节溶液pH值,除去大部分杂质,
故答案为:除去多余的硫酸,同时调整pH,除去大部分杂质;
(4)“沉锂”过程是碳酸钠与Li2SO4反应生成Li2CO3,反应方程式为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4,
故答案为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4;
(5)温度越高,碳酸锂溶解度降低,减少碳酸锂溶解,可以增加产率;溶液中硫酸钠不反应,使用的碳酸钠要过量,少量碳酸锂溶解在溶液中,过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠、碳酸锂,
故答案为:温度越高,碳酸锂溶解度降低,可以增加产率;碳酸钠;碳酸锂.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程、物质分离提纯实验操作、对操作与原理的分析评价等为解答的关键,是对学生综合能力的考查,注意对工艺流程的理解,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和稀硝酸都具有氧化性 | B. | 铜与硝酸的反应属于置换反应 | ||
| C. | 硝酸可氧化Fe2+ | D. | 可用铁或铝制品盛装浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
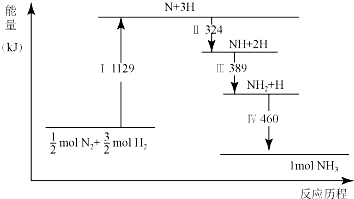
| A. | Ⅰ中破坏的均为极性键 | B. | Ⅳ中NH2与H2生成NH3 | ||
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | D. | N2(g)+3H2(g)?2NH3(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KBr+Cl2=2KCl+Br2 | B. | CaCO3=CaO+CO2↑ | ||
| C. | SO3+H2O=H2SO4 | D. | MgCl2+2NaOH=Mg(OH)2↓+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCl)>c(CH3COOH) | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 | |
| D. | 用同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63- | |
| B. | 使甲基橙变红的溶液:NH4+、CH3COO一、SO42+、Mg2+ | |
| C. | 某无色溶液:OH一、K+、ClO一、Ba2+ | |
| D. | 含有大量NO3-的溶液:K+、I一、NH4+、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com