
| A. | 12 | B. | 15 | C. | 16 | D. | 14 |
分析 能与NaOH溶液反应,而不与NaHCO3反应,结构中含有苯环且苯环上只有一个链状取代基,说明其分子中含有-COO-,分子式为C10H12O2的不饱和度为$\frac{10×2+2-12}{2}$=5,苯环和酯基的不饱和度为5,讨论羧酸与醇或酚含有的碳原子,判断形成该酯的羧酸与醇或酚的同分异构体种数确定酯的种类.
解答 解:能与NaOH溶液反应,而不与NaHCO3反应,说明其分子中含有-COO-,分子式为C10H12O2的不饱和度为$\frac{10×2+2-12}{2}$=5,苯环和酯基的不饱和度为5,
若为苯酚和丁酸酯化,苯酚有1种,丁酸有2种,形成的酯有2种;
若为苯甲醇和丙酸酯化,苯酚有1种,丙酸有1种,形成的酯有1种;
若为苯乙醇和乙酸酯化,苯乙醇有2种,乙酸有1种,形成的酯有2种;
若为苯丙醇和甲酸酯化,苯丙醇有3种,甲酸有1种,形成的酯有3种;
若为苯甲酸和丙醇酯化,苯甲酸有1种,丙醇有2种,形成的酯有2种;
若为苯乙酸和乙醇酯化,苯乙酸有2种,乙醇有1种,形成的酯有2种;
若为苯丙酸和甲醇酯化,苯丙酸有3种,甲醇有1种,形成的酯有3种;
所以共15种产物符合题意,故选B.
点评 本题考查同分异构体的书写与判断,难度中等,关键是形成酯的羧酸与醇的同分异构体的判断,注意利用数学法进行计算.


科目:高中化学 来源: 题型:选择题
| A. | 向淀粉水解后的溶液中滴加碘水,即可检验淀粉是否水解 | |
| B. | NaAlO2 溶液中滴加 Na2 CO3 溶液,有沉淀和气体生成 | |
| C. | 将 SO2 分别通入硝酸钡溶液和溶有氨气的氯化钡溶液中产生的沉淀成分不同 | |
| D. | 用铂丝蘸取少量试液进行焰色反应,火焰呈黄色的一定是钠盐溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C 与 14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3 与 CH3CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
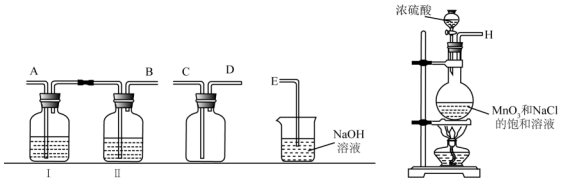
| 操作 | 现象 |
| 取漂粉精固体,加入水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的PH | 试纸先变蓝(约为12),后褪色 |
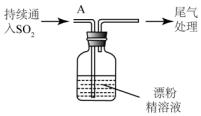 | i.液面上方出现雾状物 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于二烯烃 | |
| B. | 和Br2加成,可能生成4种物质 | |
| C. | 1mol可以和3molH2反应 | |
| D. | 和CH3H218OH反应,生成水的摩尔质量为20g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com