
| A、铝元素位于第3纵行 |
| B、过渡元素在周期表中占10个纵行 |
| C、第17纵行所有元素的化合价都有+7价 |
| D、第16纵行元素都是非金属元素 |


科目:高中化学 来源: 题型:
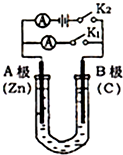 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由2H和18O所组成的水11g,所含的中子数为5NA |
| B、一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
| C、标准状况下,2.24L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA |
| D、0.1mol CH4所含的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na和O2 |
| B、NaOH溶液和CO2 |
| C、Fe和Cl2 |
| D、NaAlO2溶液和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、②③⑤⑥ | D、①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 玻璃 | 硫酸 | 氨水 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 醋酸 | 水 |
| C | 胆矾 | 浓硫酸 | 生石灰 | 水 | 二氧化碳 |
| D | 硝酸 | 盐酸 | 硫酸 | 醋酸 | 氢气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com